Entenda a VAA
Nossa compreensão sobre a VAA (vasculite associada ao ANCA) está em constante evolução.

Entenda a VAA
Nossa compreensão sobre a VAA (vasculite associada ao ANCA) está em constante evolução.
Understand AAV
Nossa compreensão sobre a VAA (vasculite associada ao ANCA) está em constante evolução.
Menu


Introdução à VAA
Incidência e prevalência
A VAA é uma vasculite de pequenos vasos rara e grave que afeta múltiplos órgãos e possui um alto risco de mortalidade aguda.1
Tipos de VAA
Os dois subtipos mais comuns de VAA são a granulomatose com poliangeíte (GPA, anteriormente chamada de Wegener’s) e a poliangeíte microscópica (PAM). Outro subtipo é a granulomatose eosinofílica com poliangeíte (GEPA, anteriormente chamada síndrome de Churg-Strauss).2,3 Este site se focará principalmente na GPA e na PAM.
A VAA é uma doença rara2
- Prevalência global: 30 a 218 por milhão de pessoas4
- Incidência europeia: 13 a 20 por milhão de pessoas por ano2,4
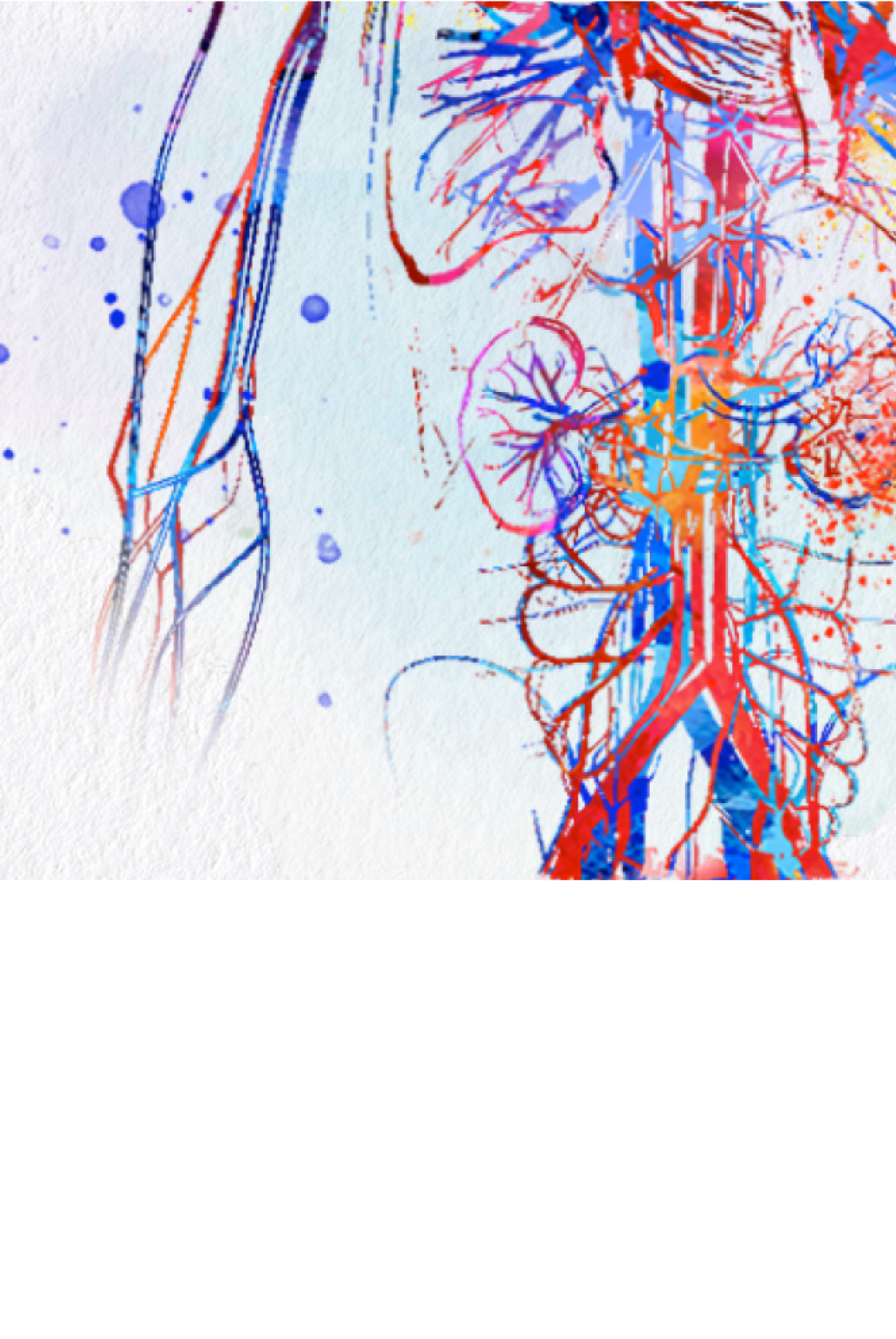
Ocorrência de VAA
- A VAA pode afetar tanto jovens quanto idosos, mas é rara em crianças e jovens, e a incidência aumenta com a idade2,5
- A VAA é um pouco mais frequente em homens (taxa de incidência anual de aproximadamente 60%) do que em mulheres2,5
Referências e notas de rodapé
Abreviações
VAA, vasculite associada ao ANCA; ANCA, anticorpo anticitoplasma de neutrófilos; GEPA, granulomatose eosinofílica com poliangeíte; GPA, granulomatose com poliangeíte; PAM, poliangeíte microscópica
Referências
- Hutton HL, et al. Semin Nephrol 2017;37(5):418–35.
- Watts RA, et al. Nephrol Dial Transplant 2015;30(Suppl 1):i14–22.
- Yates M, et al. Ann Rheum Dis 2016;75(9):1583–94.
- Mohammad AJ. Rheumatology (Oxford) 2020;59:iii42–50.
- Watts RA, et al. Arthritis Rheum 2000;43(2):414–9.
- Watts RA, et al. Rheumatology (Oxford) 2017;56(9):1439–40.
BR-AVA-2500003 | Data de preparação: julho de 2025
Introdução à VAA
Danos orgânicos sistêmicos
A VAA levar a lesão e falencia de órgãos, sendo os rins e pulmões os maiores alvos.1-3
A VAA pode provocar danos a órgãos vitais, como os pulmões, rins, sistema nervoso, sistema gastrointestinal, pele, olhos e coração.3,4 A GPA e a PAM apresentam muitas semelhanças clínicas, enquanto a GEPA é notadamente distinta..2
Até 23% (n=11/48) dos pacientes positivos para PR3- e MPO-ANCA que necessitam de TRS no momento do diagnóstico vão a óbito dentro de 6 meses e 29% (n=14/48) não recuperam a função renal.5* Já Em pacientes com envolvimento renal no diagnóstico, a DRC ocorre em 13% (n=9/72) dos pacientes positivos para PR3- e MPO-ANCA em até 3 anos após o diagnóstico. Pacientes com uma fase prodrômica longa (>22 semanas entre os primeiros sintomas de VAA e o diagnóstico) têm maior probabilidade de apresentar proteinúria aos 6 meses e possuem duas vezes mais risco de desenvolver DRC em até 3 anos, em comparação com aqueles com um curto período prodrômico. Esses dados reforçam a importância do diagnóstico precoce para melhorar os desfechos renais.6†
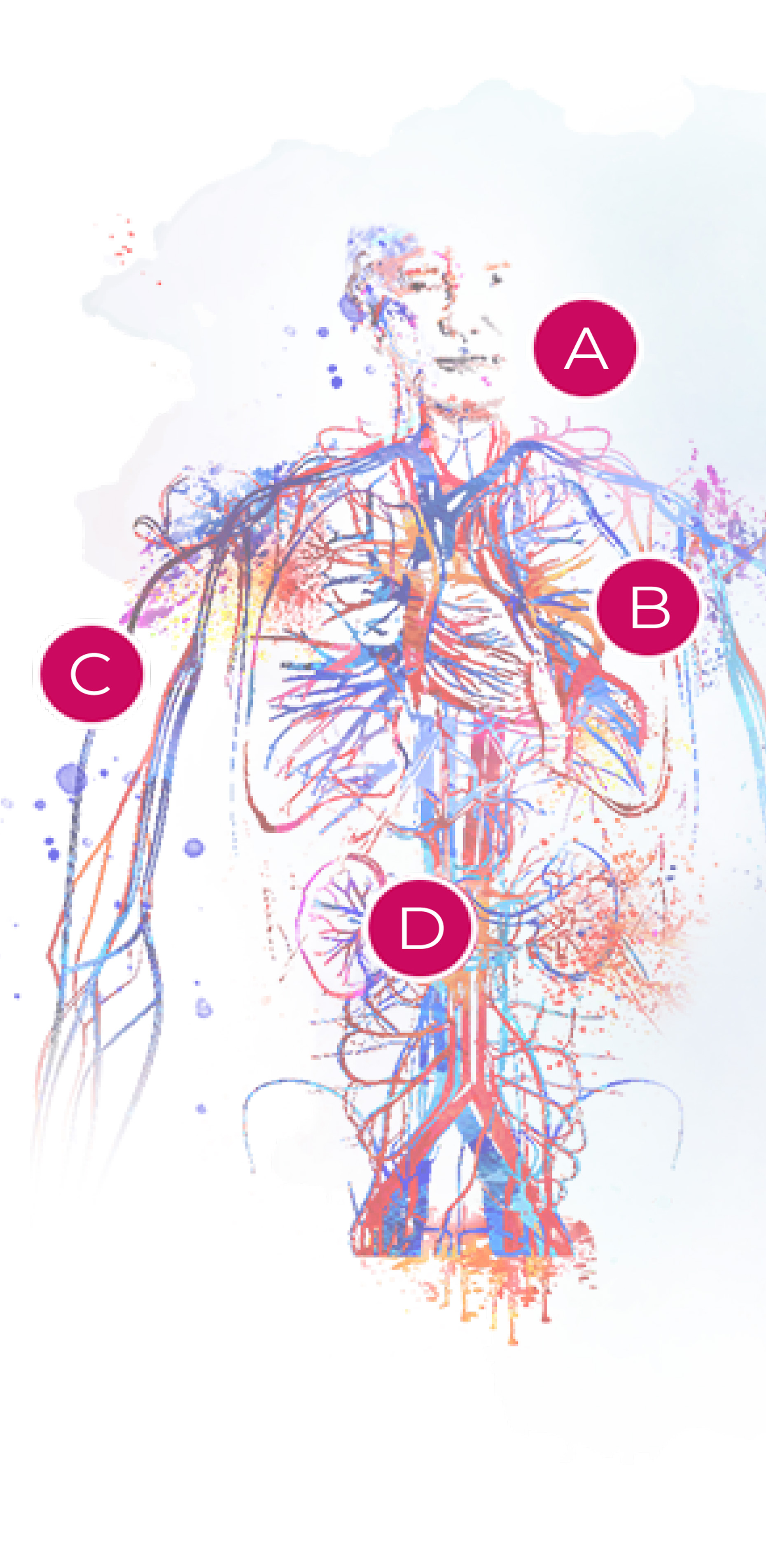
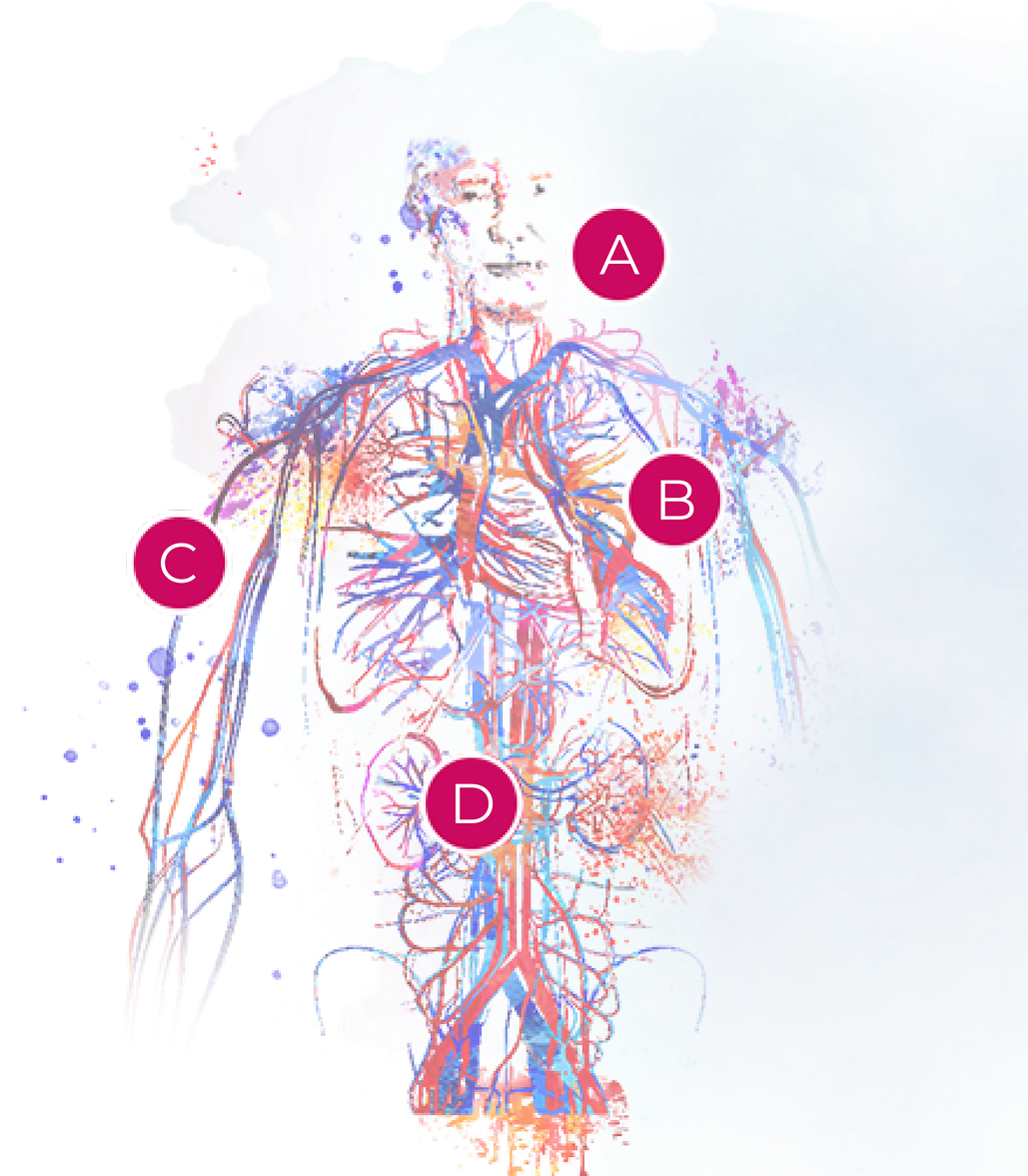
A. Olhos, nariz e garganta2
Frequência
GPA: 50–95%; PAM: 2% a 30%; GEPA: 20 a 80%
Manifestações
Manifestações
GPA: rinite crostosa, sinusite destrutiva, deformação do nariz em sela, deformação do septo nasal, otite média
PAM: manifestações inespecíficas, não destrutivas, não granulomatosas.
GEPA: rinite alérgica, polipose sinusal não destrutiva
B. Pulmões2
Frequência
GPA: 60 a 80%; PAM: 60 a 80%; GEPA: 50%
Manifestações
GPA: nódulos simples e/ou escavados no pulmão, hemorragia alveolar, estenose brônquica e/ou subglótica
PAM: hemorragia alveolar
GEPA: Infiltrado pulmonar irregular transitório e derrame pleural eosinofílico, mas raramente nódulos
C. Pele2
Frequência
GPA: 10 a 50%; PAM: 35 a 60%; GEPA: 50 a 70%
Manifestações
GPA e PAM: púrpura
GEPA: púrpura, erupção cutânea pseudourticariforme
D. Rins2
Frequência
GPA: 60 a 80%; PAM: 80%; GEPA: 20%
Manifestações
GPA, PAM e GEPA: glomerulonefrite extracapilar necrosante pauci-imune.
Pacientes com GPA e PAM acumulam danos aos órgãos pela associação entre a atividade da vasculite e EAs relacionados ao uso de glicocorticoides7–9
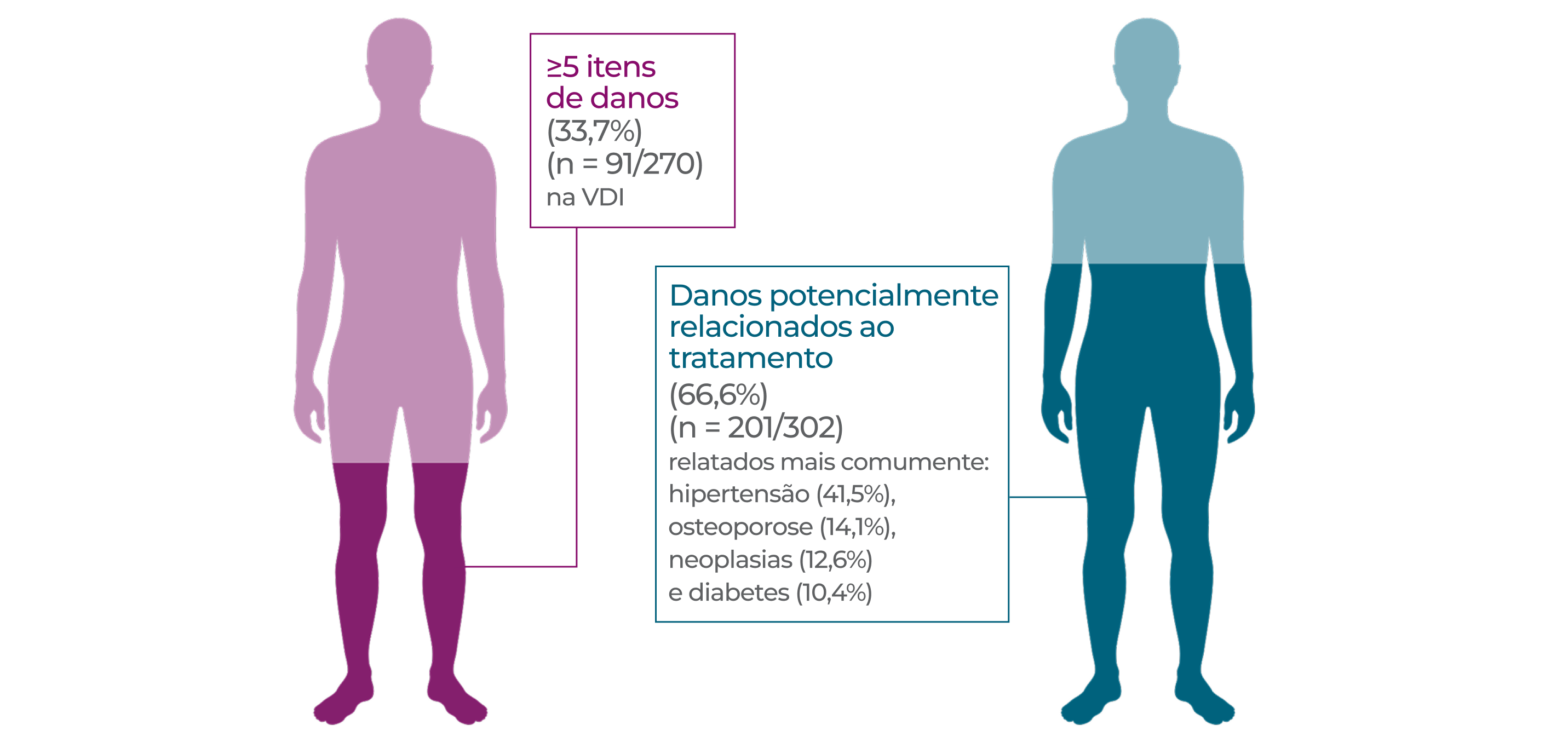
O uso prolongado e repetido de altas doses de glicocorticóides em altas doses, está associado a um aumento do risco de desenvolvimento ou agravamento de neoplasias e entre outros.7,8‡§ Em um estudo que acompanhou pacientes recém-diagnosticados com GPA e PAM por até 7 anos, a frequência de danos, incluindo alguns potencialmente relacionados ao tratamento, aumentou ao longo do período (p<0,01). Os pacientes inicialmente apresentaram um aumento precoce de lesões logo após o diagnóstico (n=270), com 81,5% (n=220/270) dos pacientes apresentando ≥ 1 item de VDI em 6 meses em comparação com 24,4% (n=66/270) dos pacientes na avaliação inicial, sendo as lesões renais (proteinúria e TFG <50 ml/minuto) e cardiovasculares (hipertensão) as mais frequentes. Danos graves, ou seja, com uma pontuação de VDI ≥5, aumentaram ao longo do tempo e, no acompanhamento de longo prazo, e acometeram 33,7% (n=91/270) dos pacientes. A hipertensão foi o item mais comumente relatado no acompanhamento de longo prazo. Na avaliação inicial, 4,8% (n=13/270) dos pacientes eram hipertensos. Dentro de 6 meses, esse número subiu para 17,0% (n=46/270) e no acompanhamento a longo prazo 41,5% (n=112/270) dos pacientes apresentavam hipertensão (p<0,01 ).8§
Níveis elevados de danos de vasculite no longo prazo foram associados de forma independente ao aumento do uso cumulativo de glicocorticoides (p=0,016).9§
Essa morbidade significativa está acompanhada por um risco aumentado de mortalidade a longo prazo, com uma razão de risco de 2,41 (IC de 95%: 1,74–3,34) em pacientes com GPA em comparação aos respectivos controles (idade e sexo correspondentes).8–10§**
Em uma média de 7 anos após o diagnóstico em pacientes com GPA ou PAM...8§
Referências e notas de rodapé
Notas de rodapé
*Pacientes com VAA com (n=212; média de idade: 58 anos; positivo para PR3-ANCA: n=138; positivo para MPO-ANCA: n=65; negativo para ANCA: n=9) e sem (n=61; média de idade: 52 anos) envolvimento renal (sedimento urinário ativo, proteinúria, função renal comprometida ou biópsia) diagnosticados e tratados com VAA em um único centro na Holanda entre janeiro de 1990 e dezembro de 2007 que foram acompanhados até a morte , perda do acompanhamento ou Dezembro de 2010.5
†Dados retrospectivos coletados de pacientes (n=72; média de idade: 64 anos) com diagnóstico clínico de VAA (definições da doença de Chapel Hill e positivo para PR3-/MPO-ANCA) e envolvimento renal no momento do diagnóstico (aumento na creatinina sérica >30% e/ou eritrocitúria [≥10 eritrócitos por campo de grande aumento e/ou cilindros eritrocitários]) em uma coorte de centro único (Northwest Clinics, Países Baixos) entre 1 de fevereiro de 2005 e 1 de fevereiro de 2015.6
‡Pacientes (n=524) com GPA ou PAM recém-diagnosticado (definições adaptadas da doença de Chapel Hill) recrutados para quatro ECRs EUVAS em 42 hospitais em 11 países europeus e México entre 1995 e 2005, e acompanhados por 1 ano.7
§Pacientes (n=735 recrutados; idade média: 57,6 anos) com GPA (55%) ou PAM (45%; definições adaptadas de doença de Chapel Hill de 1994, apresentação clínica e sorologia e/ou histologia positiva para ANCA) recrutados em seis
ECRs EUVAS entre 1995 e 2009. Dados de acompanhamento de longo prazo (n=535 pacientes elegíveis; GPA: 53%; PAM: 48%; idade média: 57,7 anos) estavam disponíveis para quatro ECRs (n=467/535 com dados disponíveis; acompanhamento médio: 7,3 anos) com dados de VDI de 302/535 pacientes (GPA: 55%; PAM: 45%; idade média:
56,8 anos; acompanhamento médio: 7,1 anos) e VDI + dados de glicocorticoides de 296/535 pacientes (GPA: 56%;
PAM: 44%: idade média: 56,6 anos).8,9
**Dados coletados de pacientes com um primeiro diagnóstico de GPA incidente (n=465; idade média: 60,3 anos) e controles não pareados por GPA (sexo, idade, ano de nascimento e ano de diagnóstico de GPA) (n=4613; idade média: 60,3 anos) do Reino Unido (The Health Improvement Network) entre 1992 e 2013. Os dados de mortalidade foram obtidos da coorte de 2003 a 201310
Abreviações
VAA, Vasculite associada ao ANCA; EA, evento adverso; ANCA, anticorpo anticitoplasma de neutrófilos; IC, intervalo de confiança; GEPA, granulomatose eosinofílica com poliangeíte; DRT, doença renal terminal; EUVAS, Sociedade Européia de Vasculite; TFG, taxa de filtração glomerular; GI, gastrointestinais; GPA, granulomatose com poliangeíte; PAM, poliangeíte microscópica; MPO, mieloperoxidase; PR3, proteinase 3; TRR, terapia renal substitutiva; ECR, ensaio clínico randomizado; VDI, índice de danos por vasculite
Referências
- Hutton HL, et al. Semin Nephrol 2017;37(5):418–35.
- Pagnoux C. Eur J Rheumatol 2016;3(3):122–33.
- Kitching A, et al. Nat Rev Dis Primers 2020;6(1):71.
- Al-Hussain T, et al. Adv Anat Pathol 2017;24(4):226–34.
- De Joode AAE, et al. Clin J Am Soc Nephrol 2013;8(10):1709–17.
- Houben E, et al. BMC Nephrol 2017;18(1):378.
- Little MA, et al. Ann Rheum Dis 2010;69(6):1036−43.
- Robson J, et al. Ann Rheum Dis 2015;74(1):177–84.
- Robson J, et al. Rheumatology (Oxford) 2015;54(3):471–81.
- Wallace ZS, et al. Semin Arthritis Rheum 2016;45(4):483–9.
BR-AVA-2500003 | Data de preparação: julho de 2025
Introdução à VAA
Mortalidade e morbidade
A VAA leva a um aumento do risco de mortalidade, especialmente no primeiro ano após o diagnóstico1,2*
No primeiro ano após o diagnóstico de GPA ou PAM (n=524), a taxa de mortalidade é de 10,7% (n=56)1*
Desses pacientes: Metade (50%) de mortalidade no primeiro ano se deve a infecções relacionadas ao tratamento1
Em contextos de estudos clínicos, a taxa de sobrevida cumulativa em 2 e 5 anos em pacientes com GPA e PAM recém-diagnosticados é de 85% e 78%, respectivamente.3†
Dados populacionais sugerem que a taxa de mortalidade no longo prazo em pacientes com VAA melhorou consideravelmente nas últimas duas décadas, mas ainda não é a mesma dos controles correspondentes.2‡
Em um estudo que seguiu indivíduos por uma mediana de 5,2 anos, a taxa de mortalidade em pacientes incidentes com GPA ou PAM recebendo tratamento atual foi 2,6 vezes maior do que a de uma população geral pareada por idade e sexo (p<0,0001).3†
Referências e notas de rodapé
Notas de rodapé
*Pacientes (n=524) com GPA ou PAM recém-diagnosticada (definições adaptadas da doença de Chapel Hill) recrutaram quatro ECRs EUVAS em 42 hospitais em 11 países europeus e México entre 1995 e 2005, e acompanhados por 1 ano.1
†Pacientes (n=535; idade mediana: 61 anos) com diagnóstico recente de GPA (53%) ou PAM (47%; definições adaptadas de doença de Chapel Hill de 1994, apresentação clínica e sorologia e/ou histologia positiva para ANCA) recrutaram quatro ECRs EUVAS em 70 hospitais universitários e gerais em 15 países entre 1995 e 2002, com uma mediana de 5,16 anos de acompanhamento para todos os pacientes. Uma coorte de controle foi pareada por idade, sexo, ano e país.3
‡Dados coletados de pacientes com um primeiro diagnóstico de incidente de GPA (n=465; idade média: 60,3 anos) e controles não pareáveis com GPA (sexo, idade, ano de nascimento e ano de diagnóstico de GPA) (n=4.613; idade média: 60,3 anos) do Reino Unido (The Health Improvement Network) entre 1992 e 2013, e divididos em duas coortes com base no ano do diagnóstico (1992 a 2002 e 2003 a 2013).2
Abreviações
VAA, vasculite associada ao ANCA; ANCA, anticorpo anticitoplasma de neutrófilos; EUVAS, Sociedade Européia de Vasculite; GPA, granulomatose com poliangeíte; PAM, poliangeíte microscópica; ECR, ensaio clínico randomizado
Referências
- Little MA, et al. Ann Rheum Dis 2010;69(6):1036−43.
- Wallace ZS, et al. Semin Arthritis Rheum 2016;45(4):483–9.
- Flossmann O, et al. Ann Rheum Dis 2011;70(3):488–94.
BR-AVA-2500003 | Data de preparação: julho de 2025
Introdução à VAA
Encaminhamento, diagnóstico e acompanhamento
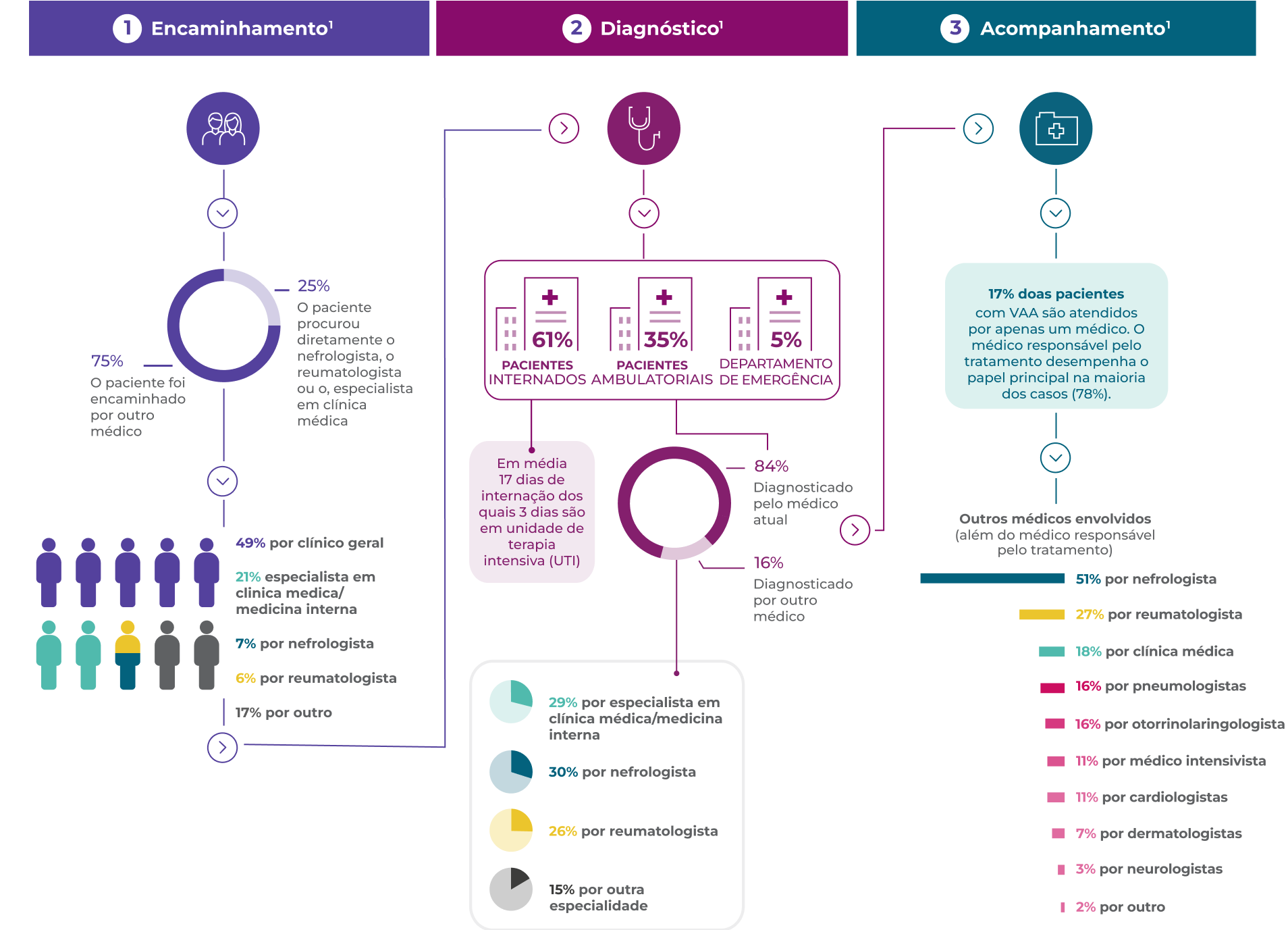
Pacientes com VAA frequentemente enfrentam um complexo processo de encaminhamento e diagnóstico1*
As recomendações da EULAR declaram que os pacientes devem ter acesso à educação com foco no impacto da VAA e seu prognóstico, principais sintomas de alerta e tratamento (incluindo complicações relacionadas ao tratamento). A VAA requer manejo multidisciplinar em centros que possuam ou tenham fácil acesso a expertise específica em vasculite.2
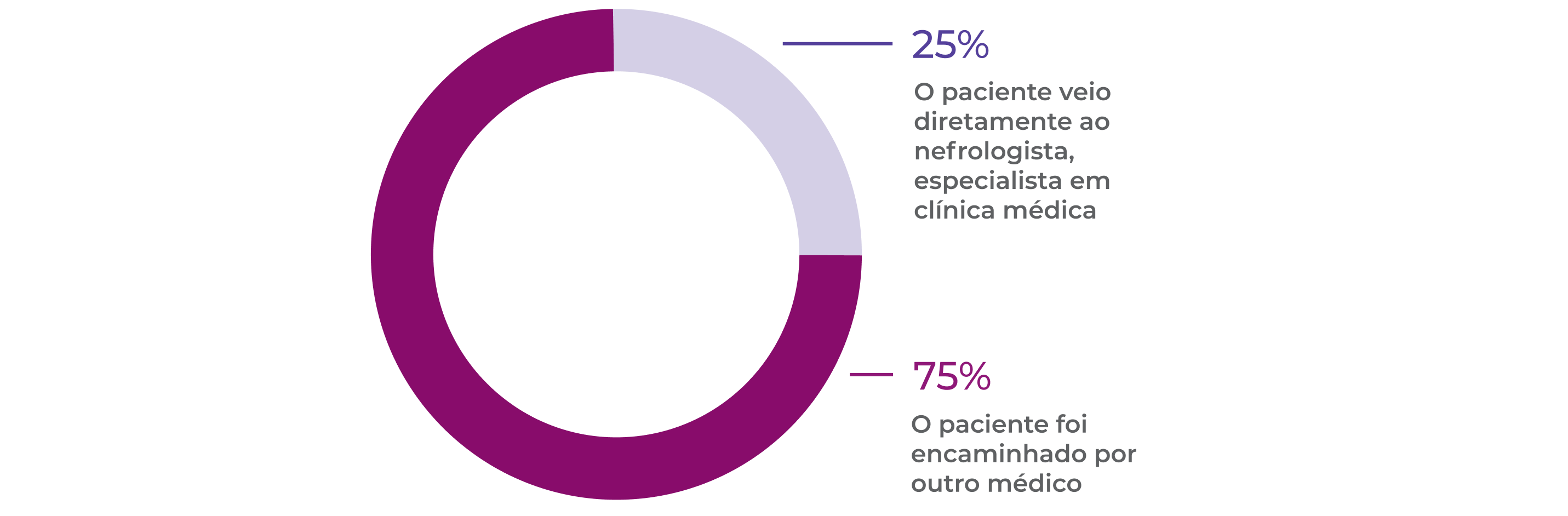
A maioria dos pacientes é encaminhada por outros médicos1
Muitos pacientes apresentam doença renal no início, mas os sintomas gerais inespecificos são os mais comuns nos encaminhamentos predominam nos encaminhamentos1
Doença renal: 64%
Fadiga: 58%
Febre: 54%
Perda de peso: 53%
Dor articular: 47%
16% dos pacientes apresentam sintomas por mais de 3 meses antes de receberem um diagnóstico de VAA1
Comorbidades no diagnóstico são comuns (65% dos pacientes)1
Hipertensão: 45%
Diabetes tipo 2: 16%
DPOC/asma: 15%
Doença arterial coronariana: 10%
Artrite: 9%
Osteoporose: 7%
IMC > 35: 6%
Insuficiência cardíaca: 6%
A raridade relativa e a apresentação clínica inespecífica de VAA podem levar a um atraso no diagnóstico da doença de mais de 6 meses em um terço dos pacientes.3
O diagnóstico de VAA e a diferenciação nos subtipos GPA, PAM ou GEPA dependem da constelação de sintomas clínicos do paciente, dos resultados de estudos de imagem e da investigação laboratorial.3,4
Devido à associação de anti-PR3 com GPA e anti-MPO com PAM, o teste de ANCA é fundamental para o diagnóstico.3–7
- Até 20% dos pacientes com GPA e PAM e mais de 60% dos pacientes com GEPA são negativos para ANCA4
- Um resultado positivo para o teste ANCA pode ser encontrado em outros quadros clínicos, p. ex., hepatite autoimune, colite ulcerativa, infecção pelo vírus da hepatite C ou HIV, ou endocardite infecciosa, sem vasculite associada4
Uma biópsia de órgão, geralmente renal, é frequentemente realizada para confirmar o diagnóstico.3,4
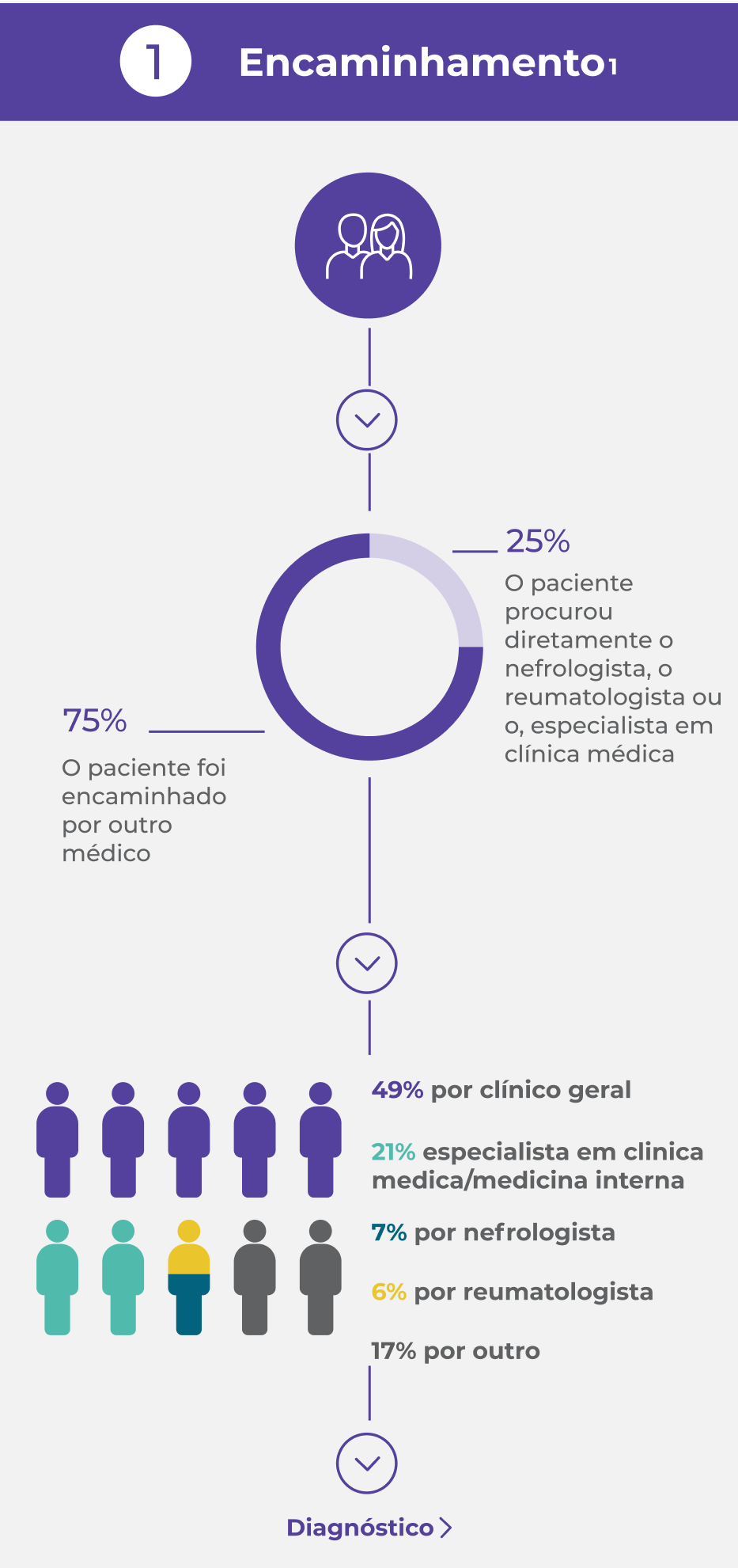
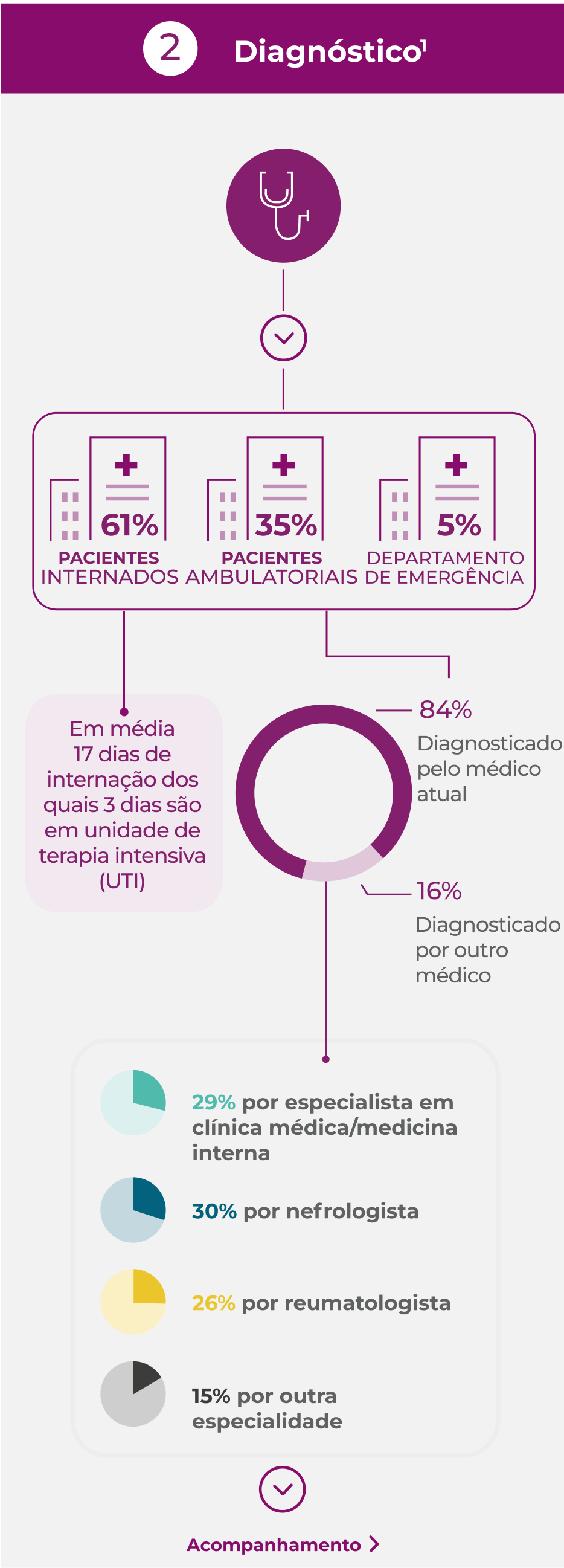
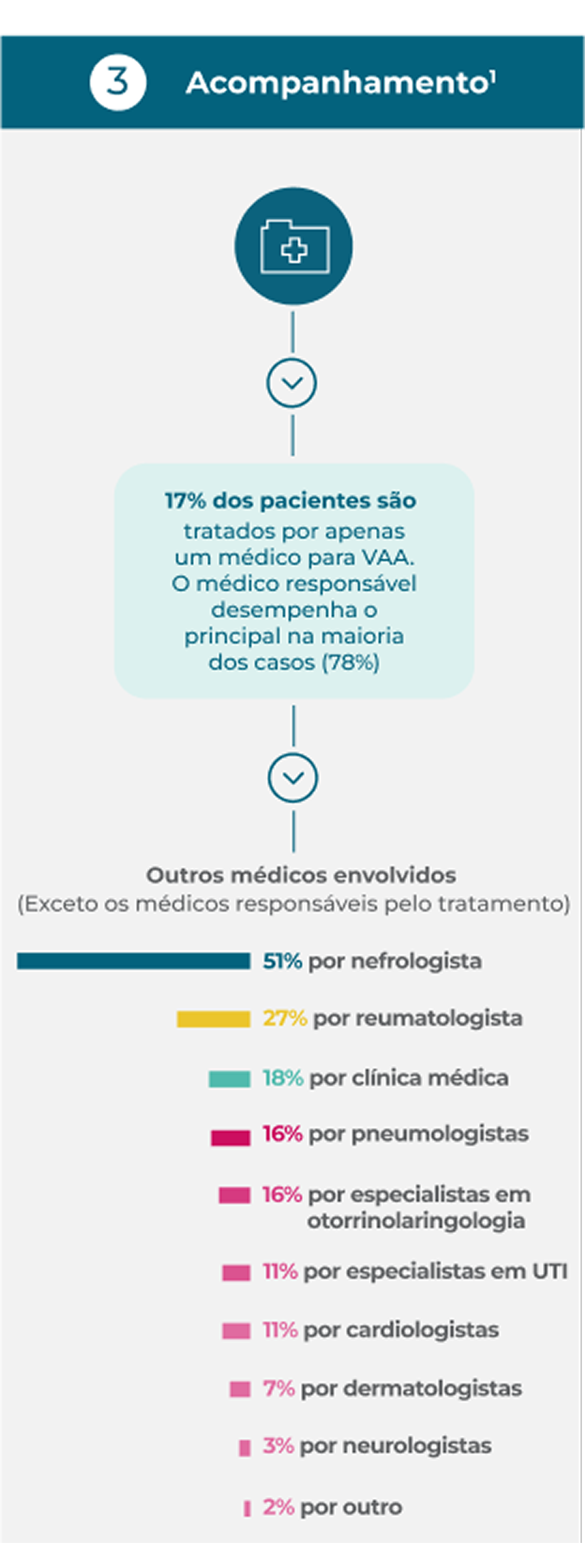
Referências e notas de rodapé
Notas de rodapé
*Estudo retrospectivo analisando 929 pacientes com VAA incidente (GPA: 54%; PAM: 46%; idade média: 57 anos; homens: 53,7%) na França, Alemanha, Itália e Reino Unido (399 médicos) que iniciaram a terapia de indução da remissão entre novembro de 2014 e fevereiro de 2017 com dados coletados na apresentação da avaliação inicial e após 1, 3, 6 e 12 meses de tratamento.1
Abreviações
VAA, vasculite associada ao ANCA; ANCA, anticorpo anticitoplasma de neutrófilos; IMC, índice de massa corporal; DPOC, doença pulmonar obstrutiva crônica; GEPA, granulomatose eosinofílica com poliangeíte; EULAR, Aliança Europeia de Associações de Reumatologia; GPA, granulomatose com poliangeíte; HIV, vírus da imunodeficiência humana; UTI, unidade de terapia intensiva; MPA, poliangeíte microscópica; PAM, poliangeíte mieloperoxidase; PR3, proteinase 3
References
- Rutherford PA, et al. J Am Soc Nephrol 2018;29:839(Abstract SA-PO403).
- Hellmich B, et al. Ann Rheum Dis 2023;0:1–18.
- Yates M, Watts R. Clin Med (Lond) 2017;17(1):60–4.
- Pagnoux C. Eur J Rheumatol 2016;3(3):122–33.
- Al-Hussain T, et al. Adv Anat Pathol 2017;24(4):226–34.
- Chen M, et al. Medicine (Baltimore) 2008;87(4):203–9.
- Lionaki S, et al. Arthritis Rheum 2012;64(10):3452–62.
BR-AVA-2500003 | Data de preparação: julho de 2025
Mecanismo da doença
Patogênese da VAA
A interação entre a via alternativa do complemento ativada, neutrófilos e C5a está associada aos danos causados pela vasculite na VAA.1
A evolução da VAA é um processo autoimune complexo e multifatorial2,3
As causas iniciais da VAA não estão ainda totalmente esclarecidas.3 Fatores de predisposição, como infecção microbiana, influência genética, agentes ambientais e medicamentos específicos, são todos fundamentais para o desenvolvimento da VAA.2,3
A exposição à sílica, pesticidas, fumaças, materiais de construção, hidrocarboneto (agentes de limpeza, tinta, diesel), medicamentos (propiltiouracil, hidralazina, D-penicilamina, cefotaxima, minociclina, agentes anti-TNF, fenitoína) e certos agentes psicoativos podem desencadear VAA.2,3
Envolvimento do ANCA
Perda de tolerância imunológica aos antígenos do ANCA e produção do ANCA pelas células plasmáticas2
O ANCA é mais comumente direcionado contra as enzimas lisossômicas dos de neutrófilos, como a PR3 e a MPO que estão associadas, respectivamente, à GPA e PAM, respectivamente2-6
Os neutrófilos são preparados
Os neutrófilos são preparados por citocinas inflamatórias (TNF-α, IL-1 e IL-18) produzidas em resposta a uma infecção ou outro evento, com predisposição genética também relevante3,7,8
Antígenos ANCA apresentados
Neutrófilos preparados apresentam antígenos ANCA (p. ex., MPO e PR3) em sua superfície celular que se ligam ao ANCA, resultando em ativação de neutrófilos2,3,7,8
Mediadores de inflamação liberados
Os neutrófilos ativados aderem-se à parede do vaso sanguíneo e penetram nela, e liberam mediadores de inflamação e lesão celular, p. ex., NETS2,3,7
Via alternativa do complemento ativada
Os neutrófilos ativados também liberam fatores como a properdina, que tem um papel autócrino na ativação da via alternativa do complemento, levando à geração de C5a2,7
Ligação de C5a a C5aR1
A ligação de C5a a C5aR1 amplifica a inflamação induzida pelo ANCA e o dano vascular7
Vasculite necrosante
Esse processo leva à vasculite necrosante em pequenos vasos sanguíneos7
Inflamação crônica
Ao longo de alguns dias, a inflamação aguda e a necrose são substituídas por inflamação crônica e cicatrizes7
Referências e notas de rodapé
Abreviações
VAA, vasculite associada ao ANCA; ANCA, anticorpo anticitoplasma de neutrófilos; C5a, componente 5a do complemento; GPA, granulomatose com poliangeíte; IL, interleucina; PAM, poliangeíte microscópica; MPO, mieloperoxidase; NETS, armadilhas extracelulares de neutrófilos; PR3, proteinase 3; R, receptor; TNF, fator de necrose tumoral
Referências
- Bekker P, et al. PLoS One 2016;11(10):e0164646.
- Hutton HL, et al. Semin Nephrol 2017;37(5):418–35.
- Al-Hussain T, et al. Adv Anat Pathol 2017;24(4):226–34.
- Chen M, et al. Medicine (Baltimore) 2008;87(4):203–9.
- Lionaki S, et al. Arthritis Rheum 2012;64(10):3452–62.
- Pagnoux C. Eur J Rheumatol 2016;3(3):122–33.
- Jennette JC, Nachman PH. Clin J Am Soc Nephrol 2017;12(10):1680–91.
- von Borstel A, et al. Autoimmun Rev 2018;17(4):413–21.
BR-AVA-2500003 | Data de preparação: julho de 2025
Mecanismo da doença
A importância do sistema complemento e neutrófilos na ativação da VAA
O C5a desempenha um papel fundamental na patogênese da VAA, amplificando a inflamação induzida por ANCA e o dano vascular1
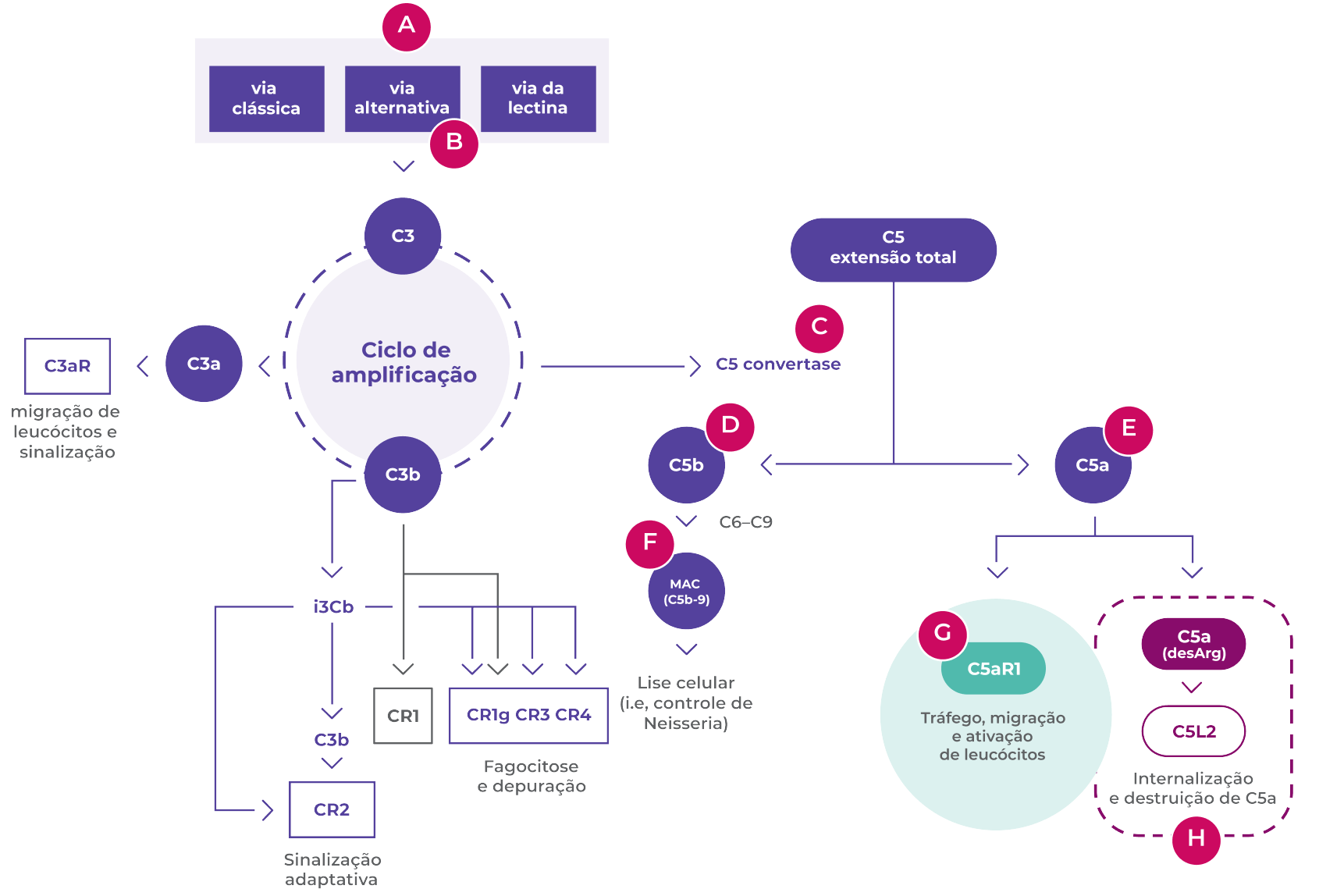
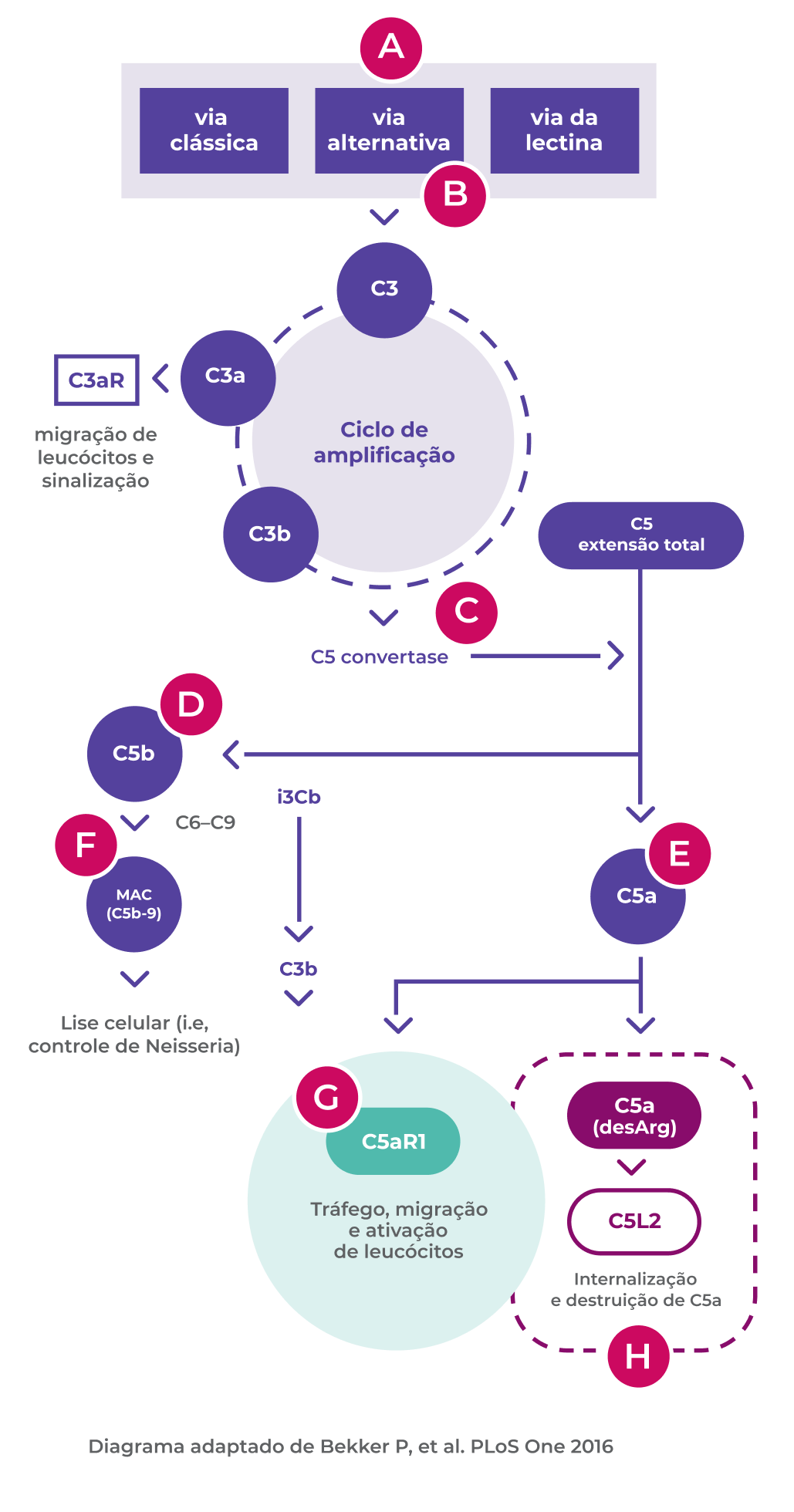
Diagrama adaptado de Bekker P, et al. PLoS One 2016
A. As três vias de ativação do complemento (clássica, de lectina e alternativa) resultam na formação de C3a, C3b, C5a e C5b-91
B. A via alternativa do complemento está em constante funcionamento através da degradação espontânea de C3 a C3b.2 É a desregulação dessa via que é relevante no VAA1
C. A C5 convertase formada durante o ciclo de amplificação cliva o C5 em C5a e C5b1
D. C5b combina com os componentes do complemento C6, C7, C8 e C9 para formar C5b-9, também conhecido como complexo terminal do complemento ou complexo de ataque à membrana1
E. C5a é a molécula efetora terminal na cascata do complemento e um potente mediador pró-inflamatório, crítico na VAA1,4
F. O complexo C5b-9 é necessário para resistência do hospedeiro contra infecções por bactérias encapsuladas, como Neisseria meningitides1,3
G. A ligação de C5a a C5aR1 resulta em dois eventos principais que atuam em um ciclo vicioso amplificando a inflamação e o dano vascular induzidos por ANCA:1,4,5
- Indução rápida da expressão de moléculas de adesão na superfície celular o que promove a quimiotaxia leucocitária1
- A exposição adicional de antígenos ANCA na superfície celular de neutrófilos facilitando sua subsequente ativação5
Além disso, acredita-se que também que o C5aR1 desempenhe um papel promovendo a autoimunidade aos antígenos ANCA aumentando a produção de ANCA.6
O C5 também media a inflamação por meio da estimulação da permeabilidade vascular, a degranulação de neutrófilos e liberação de proteases lisossômicas e radicais livres oxidativos.1,7
H. A ativação do receptor C5L2 não desempenhe um papel conhecido na VAA; em outras condições, possui ações pró e antiinflamatórias, mas ainda não completamente esclarecidas.1,8
O C5a é rapidamente degradado pela remoção do aminoácido arginina em sua extremidade C-terminal formando C5a desArg com actividade aproximadamente 10 vezes menor sobre o receptor C5aR11,9
O desArg se liga com alta afinidade ao receptor C5L2 e é subsequentemente internalizado e degradado1,10
Referências e notas de rodapé
Abreviações
VAA, vasculite associada ao ANCA; ANCA, anticorpo anticitoplasma de neutrófilos; C-terminal, carboxi terminal; MAC, complexo de ataque à membrana; R, receptor
Referências
- Bekker P, et al. PLoS One 2016;11(10):e0164646.
- Thurman JM, Holers VM. J Immunol 2006;176(3):1305–10.
- Figueroa JE, Densen P. Clin Microbiol Rev 1991;4(3):359–95.
- Jennette JC, Nachman PH. Clin J Am Soc Nephrol 2017;12(10):1680–91.
- Jennette JC, et al. Semin Nephrol 2013;33(6):557–64.
- Dick J, et al. Kidney Int 2018;93(3):615–25.
- Gerard C, et al. Annu Rev Immunol 1994;12:775–808.
- Li R, et al. FASEB J 2013;27(3):855–64.
- Monk PN, et al. Br J Pharmacol 2007;152(4):429–48.
- Cain SA, Monk PN. J Biol Chem 2002;277(9):7165–9.
BR-AVA-2500003 | Data de preparação: julho de 2025
Tratamento da VAA
Via de tratamento
Diretrizes práticas para o tratamento e manejo de pacientes com VAA
A VAA é uma condição crônica que cursa com recidivas, necessitando de terapia imunossupressora de longo prazo1–4
As recomendações da EULAR estabelecem que os pacientes com VAA devem receber o melhor cuidado possível, o qual deve ser baseado na tomada de decisão compartilhada entre o paciente e o médico, considerando eficácia, segurança e custos5
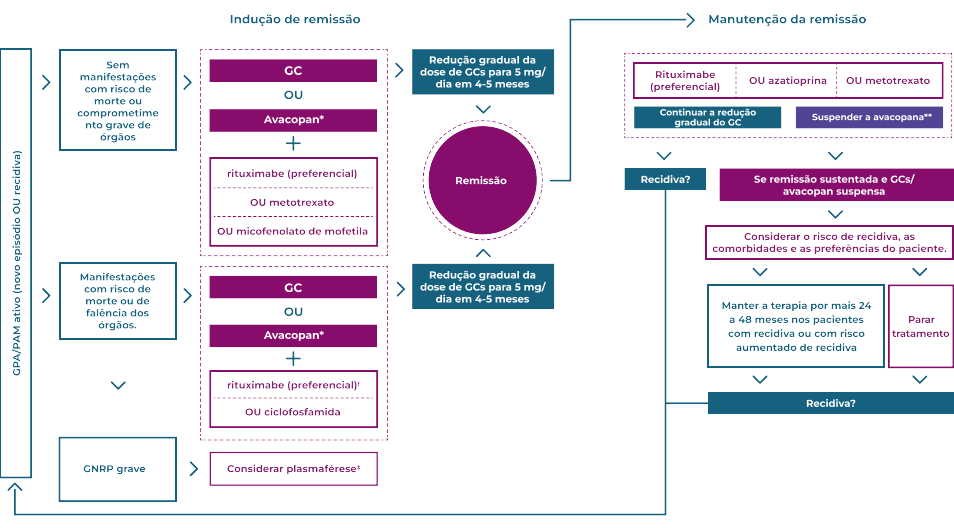
Diagrama adaptado de Hellmich B. et al. Ann Rheum Dis 2023. Consulte sempre as indicações aprovadas na bula do produto antes de prescrever
Referências e notas de rodapé
Notas de rodapé
*Como parte de uma estratégia para reduzir substancialmente a exposição a GCs.
†O Rituximabe foi preferido na doença com recidiva
‡Em pacientes com creatinina sérica >300 μmol/l devido a glomerulonefrite ativa.
§Se a remissão não for alcançada, consulte um centro especializado; se a remissão for alcançada, prossiga para a fase de manutenção.
**Interromper a avacopana após 6 a 12 meses de tratamento (não há dados sobre o uso de avacopana por mais de 1 ano, portanto, o uso a longo prazo não pode ser recomendado); no estudo ADVOCATE, a remissão sustentada até a semana 52 (o segundo desfecho primário) foi alcançada a uma taxa mais elevada nos grupos de tratamento com avacopana (65,7%) do que com GC (54,9%), sugerindo que a avacopana pode ser eficaz na sustentação remissão.
††Uma duração mais prolongada do tratamento deve ser ponderada com em relação às preferências do paciente e aos riscos de continuar a imunossupressão.
Abreviações
EULAR, Aliança Europeia das Associações de Reumatologia; GC, glicocorticoide; GNRP, glomerulonefrite rapidamente progressiva.
Referências
- Yates M, Watts R. Clin Med (Lond) 2017; 1791): 60–4.
- Ntatsaki E, et al. Rheumatology (Oxford) 2014;53(12):2306–9.
- Yates M, et al. Ann Rheum Dis 2016;75(9):1583–94.
- Rutherford PA, et al. J Am Soc Nephrol 2018;29:839(Abstract SA-PO402).
- Hellmich B, et al. Ann Rheum Dis 2023;0:1–18
BR-AVA-2500003 | Data de preparação: julho de 2025
Tratamento da VAA
O equilíbrio do tratamento
O tratamento deve equilibrar o controle da vasculite com a minimização dos danos relacionados ao tratamento1-4
No momento do diagnóstico ou recidiva da VAA, as principais preocupações em torno do tratamento envolvem o controle da atividade da vasculite e a minimização dos efeitos adversos agudos da terapia.1,2 Mais tarde, quando a remissão é alcançada, são o manejo do dano cumulativo aos órgãos, frequentemente relacionado ao uso prolongado de glicocorticoides em dose baixa, e à experiência do paciente tornam-se mais relevantes.1–4
As diretrizes da EULAR agora estabelecem que os pacientes devem ser avaliados periodicamente quanto a efeitos adversos relacionados ao tratamento e comorbidades. As diretrizes recomendam a profilaxia e orientações sobre estilo de vida para reduzir complicações relacionadas ao tratamento e outras comorbidades.5
Os EAs relacionados ao tratamento são a principal causa de mortalidade aguda6
No primeiro ano após o diagnóstico de GPA ou PAM, 56 de 524 pacientes foram a óbito. Um total de 59% (n=33/56) dessas mortes foi decorrente de EAs relacionados ao tratamento.6*
Uma revisão sistemática da literatura sobre EAs relacionados a glicocorticoides em estudos clínicos de VAA publicados entre 1 de janeiro de 2007 e 30 de janeiro de 2018 identificou mortalidade (33%) como o evento adverso grave relacionado a glicocorticoides observado durante o tratamento de indução precoce. Outros eventos adversos graves com maior frequencia associado a glicocorticoides comemente apresentados pelos pacientes incluem infecções (20%), distúrbios musculoesqueléticos (17%) e renais (15%).7†
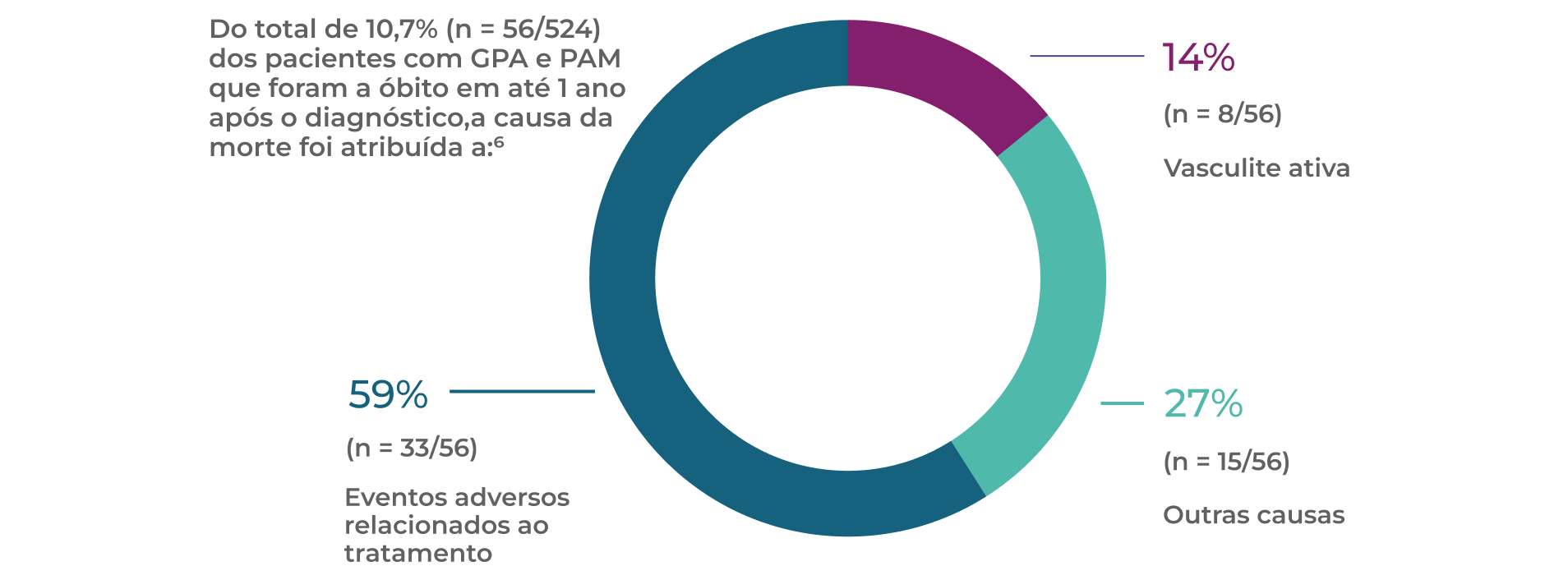
Referências e notas de rodapé
Notas de rodapé
*Os pacientes (n=524) com GPA ou PAM recém-diagnosticados (definições adaptadas da doença de Chapel Hill) foram recrutados em quatro ECRs do EUVAS em 42 hospitais em 11 países europeus e México entre 1995 e 2005 e acompanhados por 1 ano.6
†Revisão sistemática da literatura de 33 estudos publicados entre 1 de janeiro de 2007 e 30 de janeiro de 2018 contendo dados sobre EAs relacionados a glicocorticoides (qualquer ocorrência médica desfavorável) e EAs graves (definidos pela Agência Europeia de Medicamentos CPMMP/ICH/377/95) que ameaçam a vida ou função.7
Abreviações
VAA, vasculite associada ao ANCA; EA, evento adverso; ANCA, anticorpo anticitoplasma de neutrófilos; EULAR, Aliança Europeia de Associações de Reumatologia; EUVAS, Sociedade Européia de Vasculite; GPA, granulomatose com poliangeíte; PAM, poliangeíte microscópica; ECR, ensaio clínico randomizado.
Referências
- Yates M, et al. Ann Rheum Dis 2016;75(9):1583–94.
- Robson JC, et al. Rheumatol Int 2018;38(4):675–82.
- Yates M, Watts R. Clin Med (Lond) 2017;17(1):60–4.
- Robson J, et al. Rheumatology 2015;54(3):471–81.
- Hellmich B, et al. Ann Rheum Dis 2023;0:1–18.
- Little MA, et al. Ann Rheum Dis 2010;69(6):1036−43.
- Rutherford PA, et al. J Am Soc Nephrol 2018;29:840(2. Abstract SA-PO405).
BR-AVA-2500003 | Data de preparação: julho de 2025
Tratamento da VAA
Dados clínicos mais recentes em VAA

2021
O regime à base de avacopana demonstrou remissão clinica sustentada superior na Semana 52 em comparação com um o regime baseado em GC1
- Na semana 26, o regime à base de avacopana demonstrou não inferioridade em atingir a de remissão clínica comparado ao regime à base de GC (p
- Na semana 52, o regime a base de avacopana demonstrou superioridade na remissão clínica sustentada, comparado ao regime à base de GC (p=0,007)
- As incidências de eventos adversos graves foram semelhantes nos grupos de regime à base de avacopana e regime à base de GC (37,3% versus 39%, respectivamente)

2020
A redução da dose de GC em pacientes com VAA grave não impactou significativamente o desfecho primário de morte ou DRC, mas reduziu a taxa de infecção (HR=0,69)2
- O risco de morte ou DRC com dose reduzida de GC não foi inferior à dose padrão de GC
- O regime de dose reduzida diminuiu o risco de infecções graves (0,69; IC de 95%, 0,52 a 0,93) sem aumentar o risco de outros eventos adversos
- O uso contínuo de um regime com dose padrão de GC, mesmo em pacientes com VAA grave, deve ser reavaliado
- O uso de PLEX nesta população de pacientes não forneceu nenhum benefício adicional

2020
A terapia de manutenção prolongada leva a melhores desfechos clínicos3
- As taxas de recidiva foram reduzidas em pacientes recebendo tratamento com RTX em longo prazo em comparação com a terapia de manutenção padrão
- Com a terapia de manutenção padrão, as taxas de recidiva permanecem elevadas. No mês 28, 25% dos pacientes apresentaram recidiva
- Não houve diferença na incidência de EAs com o tratamento de longo prazo

2019
Os resultados preliminares mostram que uma dose reduzida de GC pode ser eficaz para a reindução da remissão na VAA, e o RTX foi superior ao AZA na manutenção da remissão4,5
- A indução da remissão com uma dose reduzida de GC deve ser considerada clinicamente, uma vez que foi tão eficaz quanto um regime de dose típico de GC
- Os achados iniciais mostram que o RTX é superior ao AZA na redução de recidivas
- Ainda ocorreram recidivas em ambos os grupos de tratamento. Aos 24 meses, 13% dos pacientes tratados com RTX e 38% dos pacientes tratados com AZA apresentaram recidiva

2018
Regimes personalizados e de cronograma fixo de RTX são igualmente eficazes na manutenção com remissão, embora ainda ocorram recidivas6
- As taxas de recidiva foram semelhantes entre os tratamentos com RTX customizado e com cronograma fixo
- O regime personalizado demonstrou que a manutenção da remissão pode ser alcançada com menos infusões de RTX
- São necessárias mais pesquisas para estabelecer exames laboratoriais confiáveis que possam prever o surgimento de recidivas

2014
O RTX é mais eficaz do que a o AZA na manutenção da remissão, mas o uso de GC e as recidivas continuam sendo comuns.7-10
- O RTX demonstrou ser uma terapia de manutenção mais eficaz do que AZA para pacientes com VAA recém-diagnosticados
- Recidvas com maior ou menor gravidade ocorreram durante toda a fase de manutenção do tratamento. No mês 28, 17% dos pacientes sofreram uma recidiva importante, aumentando para 38% no mês 60
- O uso de GC permaneceu comum entre todos os pacientes durante todo o período de acompanhamento de 60 meses

2010
O RTX demonstrou ser não inferior à CYC diária para indução e manutenção da remissão, mas as taxas de remissão permanecem variáveis11–13
- A obtenção e manutenção da remissão completa pelo paciente permanece variável com as terapias atuais
- 1 em cada 3 pacientes não consegue atingir a remissão em 6 meses sem o uso de GCs, e 1 em cada 2 não conseguiu manter a remissão em 12 meses
- A recidiva não grave é um problema clínico sub-reconhecido; esses pacientes sofrem recidivas subsequentes, resultando em alta exposição ao GC
Referências e notas de rodapé
Abreviações
VAA, vasculite associada ao ANCA; EA, evento adverso; ANCA, anticorpo anticitoplasma de neutrófilos; AZA, azatioprina; CYC, ciclofosfamida; DRC, doença renal crônica; GC, glicocorticoide; PLEX, plasmaférese; RTX, rituximabe
Referências
- Jayne D, et al. N Engl J Med 2021;384(7):599–609.
- Walsh M, et al. N Engl J Med 2020:382(7):622–31.
- Charles P, et al. Ann Intern Med 2020;173(30):179–87.
- Smith RM, et al. Ann Rheum Dis 2020;79(9):1243–96
- Smith RM, et al. J Am Soc Nephrol 2019:30.
- Charles P, et al. Ann Rheum Dis 2020;173(30):1143–9.
- Guillevin L, et al. N Engl J Med 2014;371(19):1771–80.
- Terrier B, et al. Ann Rheum Dis 2018;77(8):1150–6.
- Terrier B, et al. Ann Rheum Dis 2018;77(8): 1150–6. [Anexo suplementar]..
- Guillevin L, et al. N Engl J Med 2014;371(19):1771–80. [Anexo suplementar]..
- Stone JH, et al. N Engl J Med 2010;363(3):221–32.
- Specks U, et al. N Engl J Med 2013;369(5):417–27.
- Miloslavsky EM, et al. Arthritis Rheum 2015;67(6):1629–36.
BR-AVA-2500003 | Data de preparação: julho de 2025
Tratamento da VAA
Experiência no mundo real
Muitos pacientes não alcançam ou não mantém a remissão completa1*
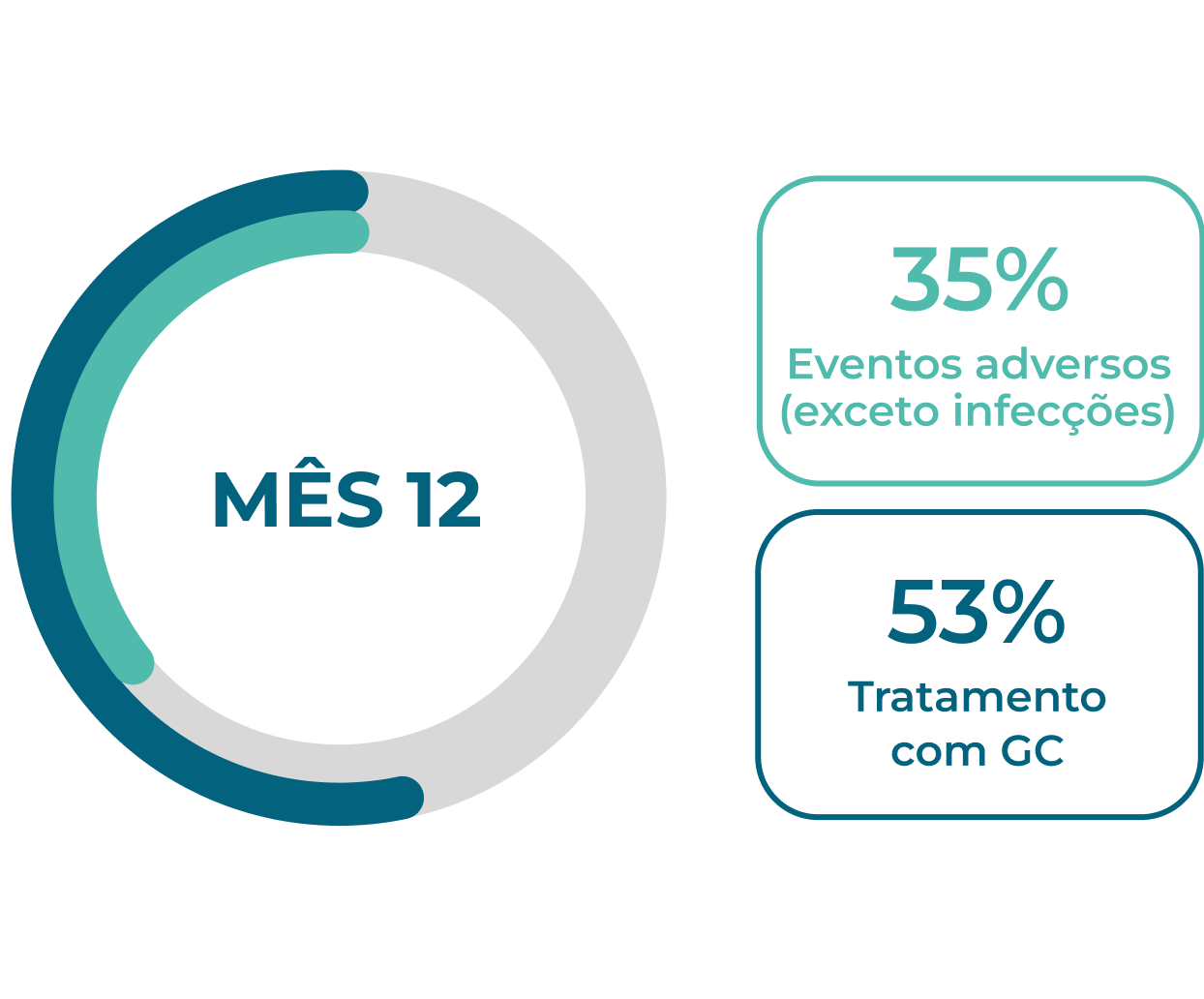
A resposta do paciente à terapia de indução de remissão é variável. Após 12 meses de tratamento (n=929), 59% dos pacientes com GPA (granulomatose com poliangeíte, anteriormente chamada de Wegener) e pacientes com PAM (poliangeíte microscópica) alcançam remissão completa, e >50% dos pacientes continuam usando glicocorticoides.1 É necessário que mais pacientes atinjam e mantenham a remissão sem o uso prolongado de glicocorticoides.
A resposta à terapia de indução é variável e muitos pacientes não alcançam uma resposta completa, mesmo aos 12 meses1
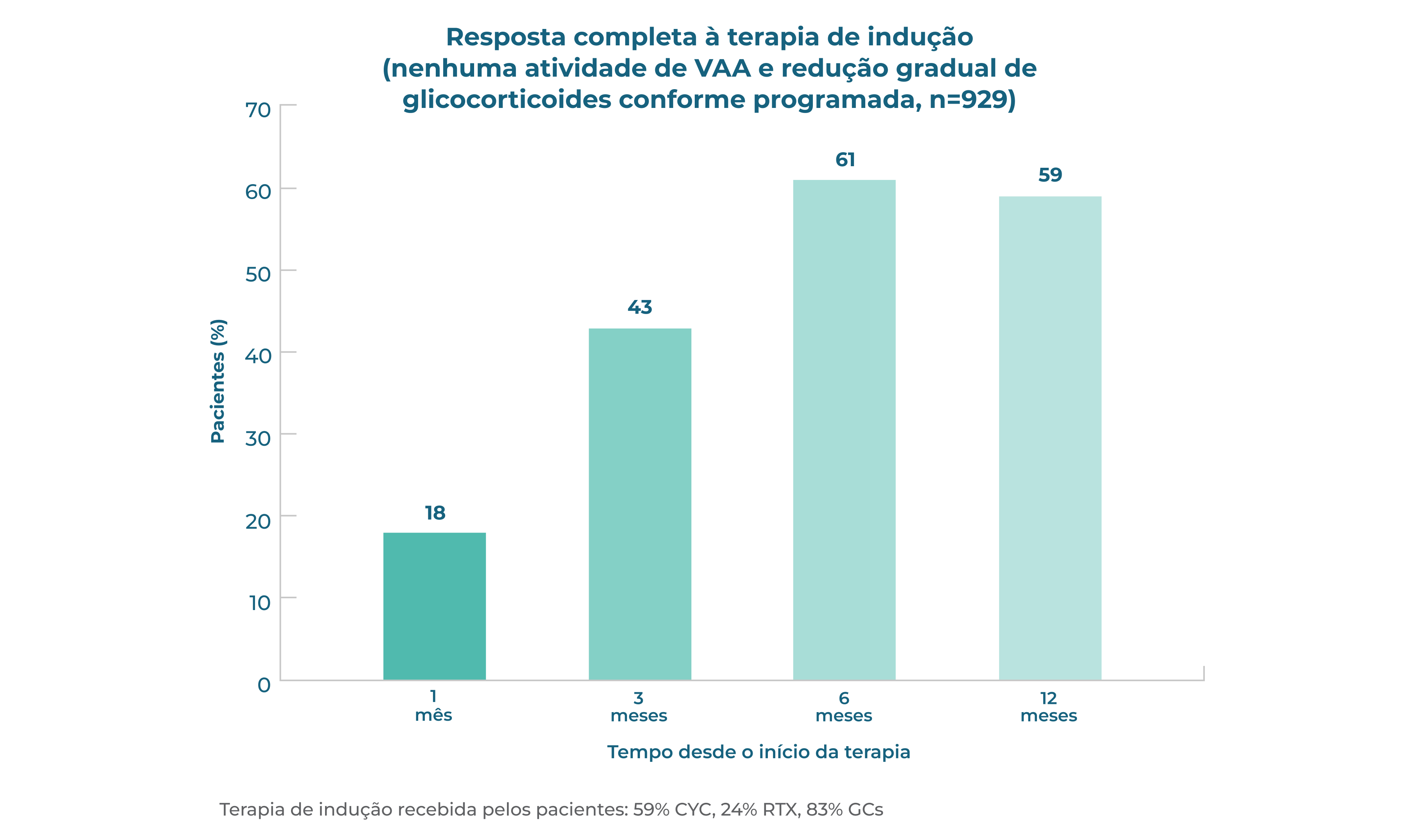
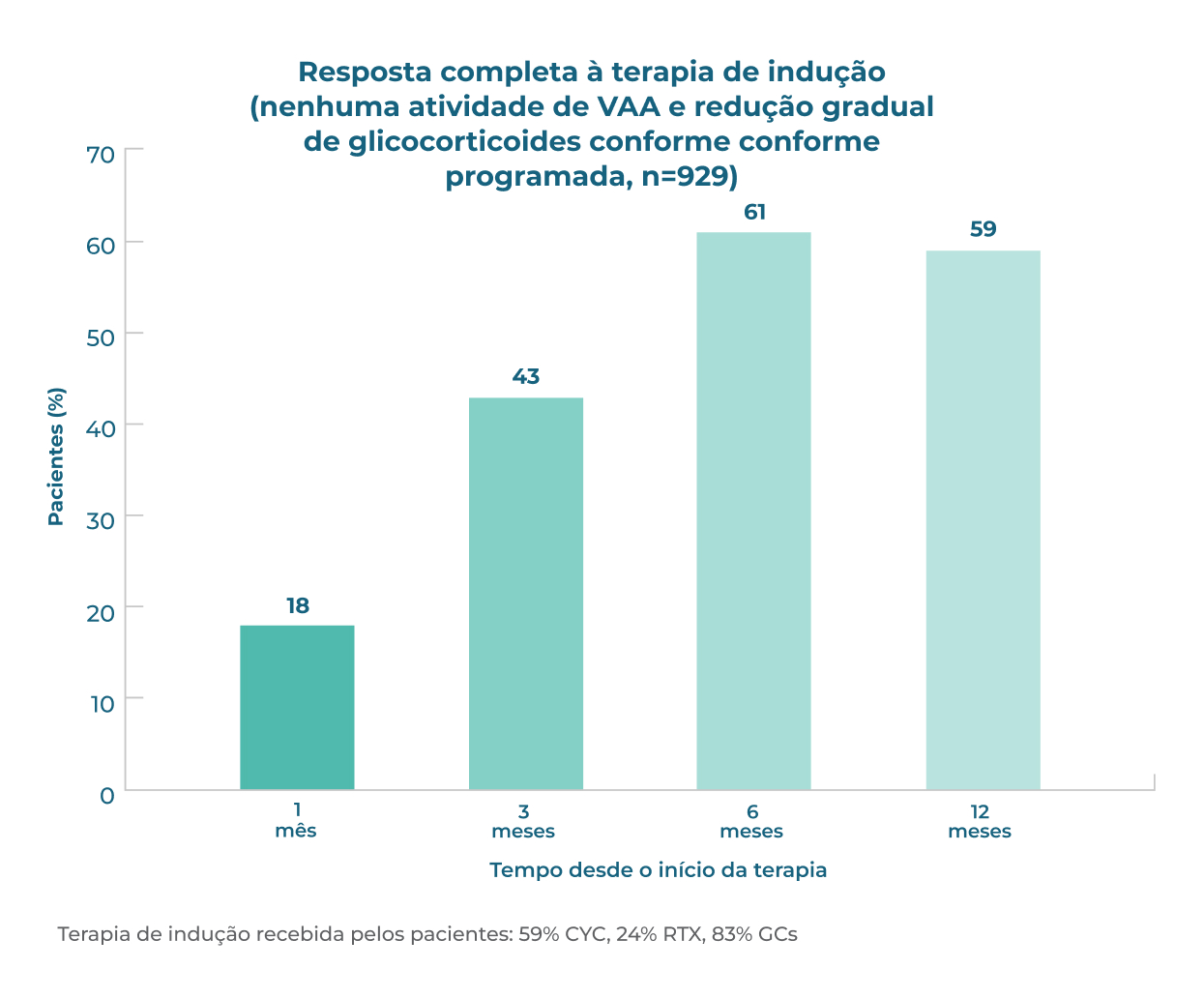
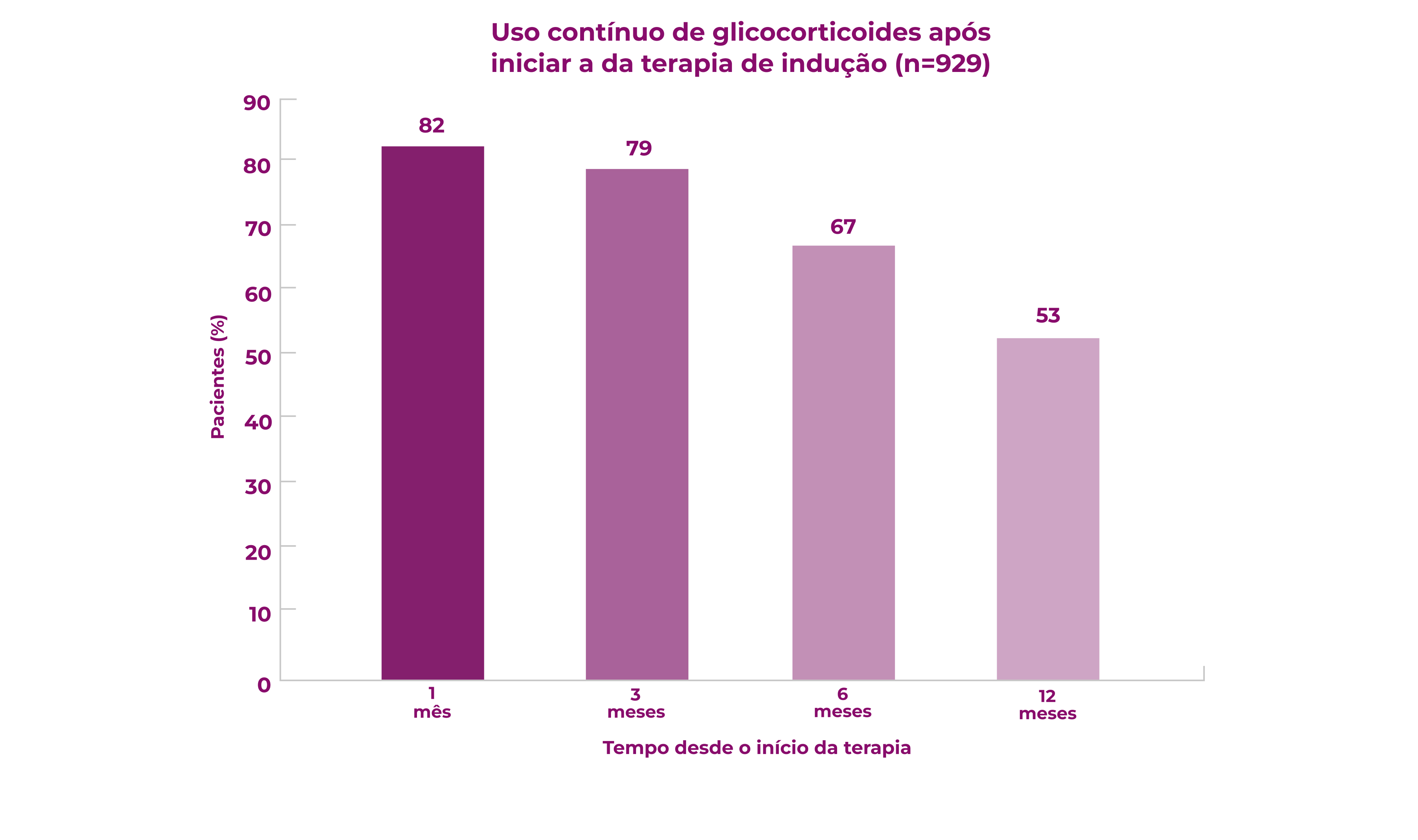
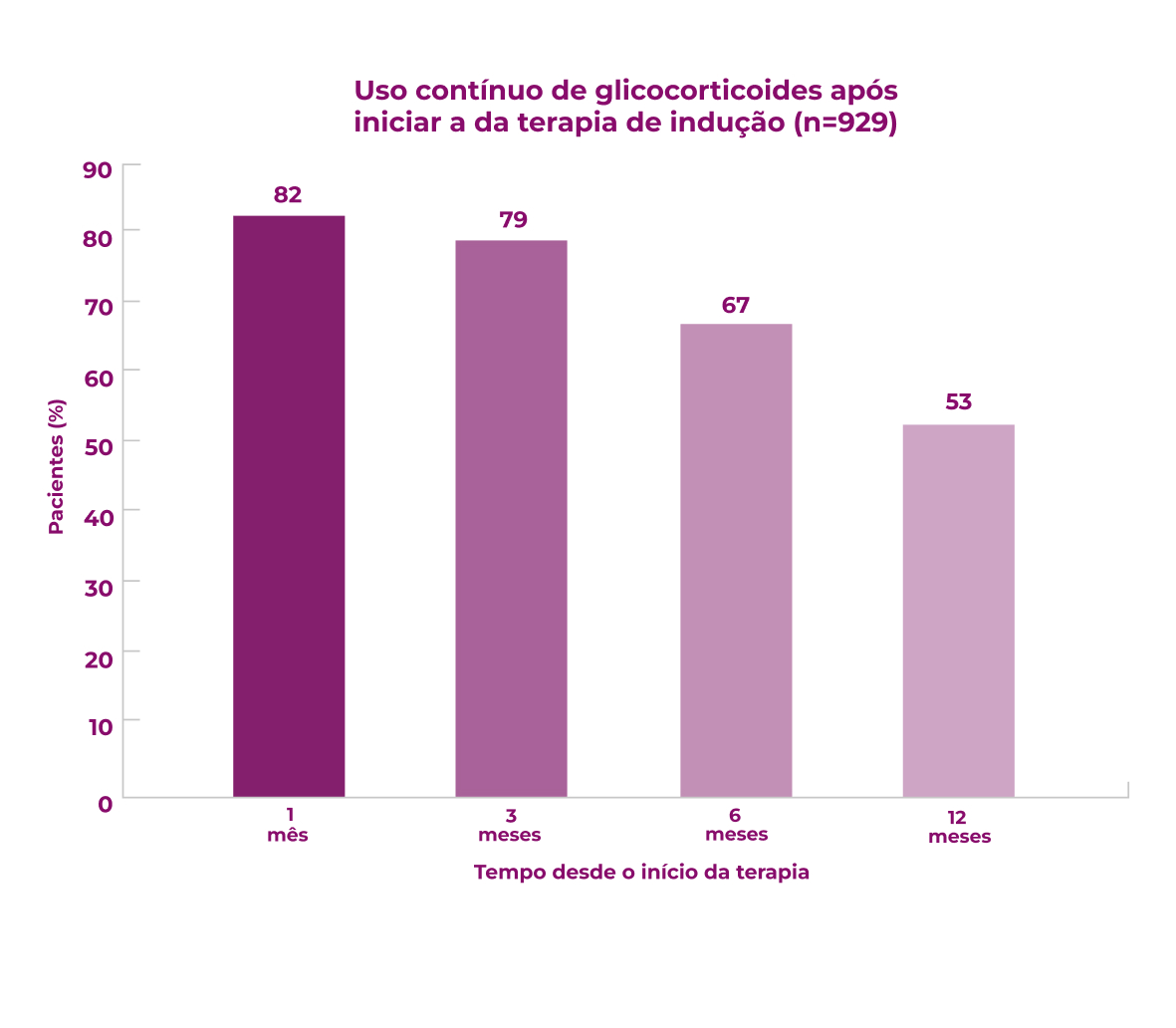
>50% dos pacientes continuam a usar glicocorticoides 12 meses após o início da terapia de indução1
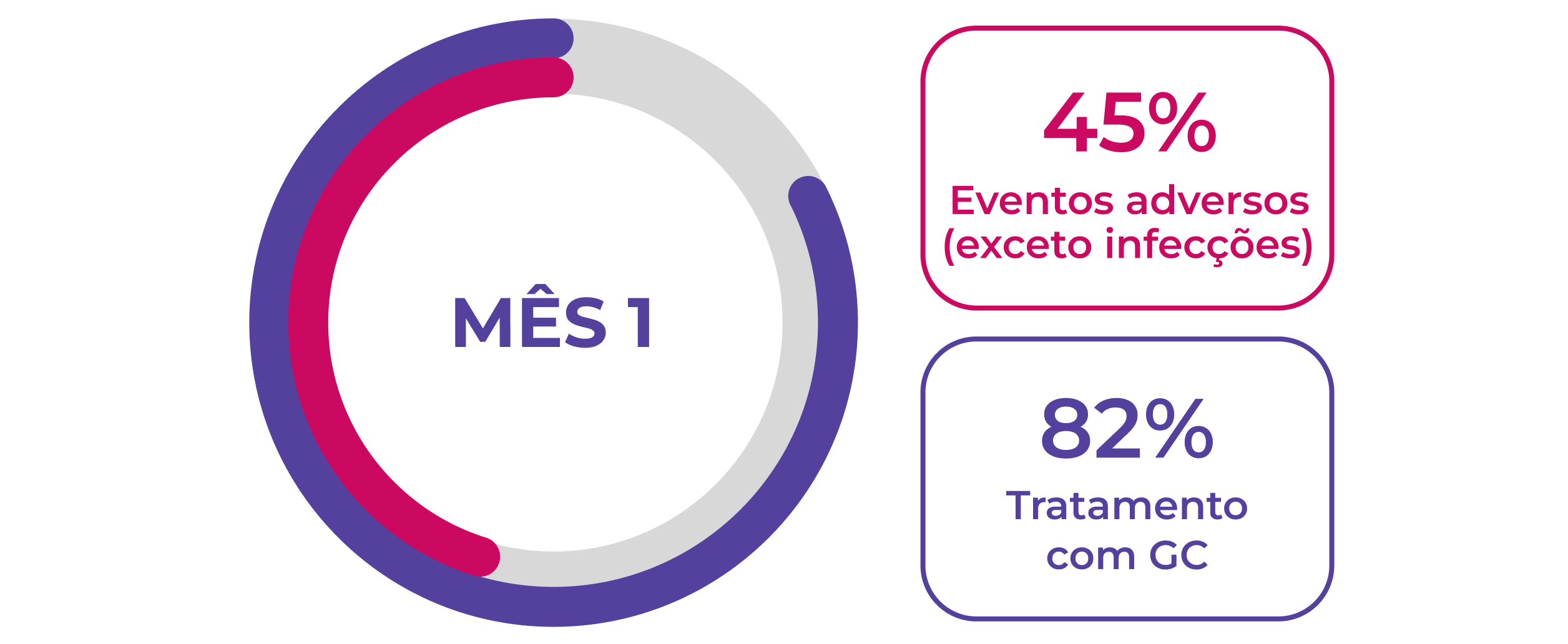
Os EAs continuam sendo um problema para pacientes novos e recidivantes1,2
Eventos adversos são comuns durante os primeiros 12 meses de tratamento em pacientes com GPA ou PAM, 1,2Neste período, a dose de glicocorticoides costuma ser mais elevada, pois as diretrizes vigentes de tratamento recomendam o uso de glicocorticoides para indução da remissão.1-3A maioria dos pacientes continua a usar glicocorticoides 12 meses após iniciar a terapia de indução da remissão.1,2
Novos pacientes (n=929)1†
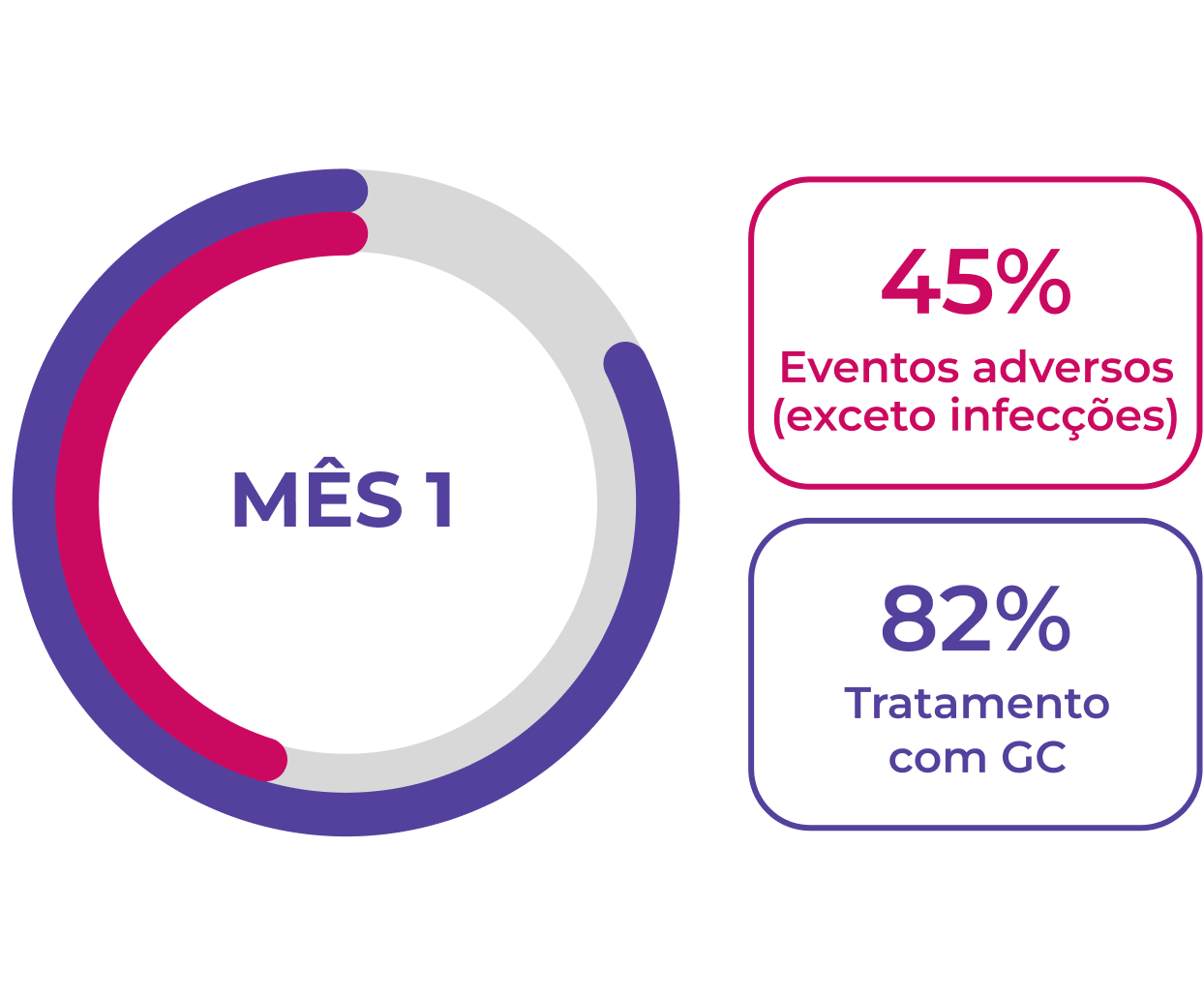

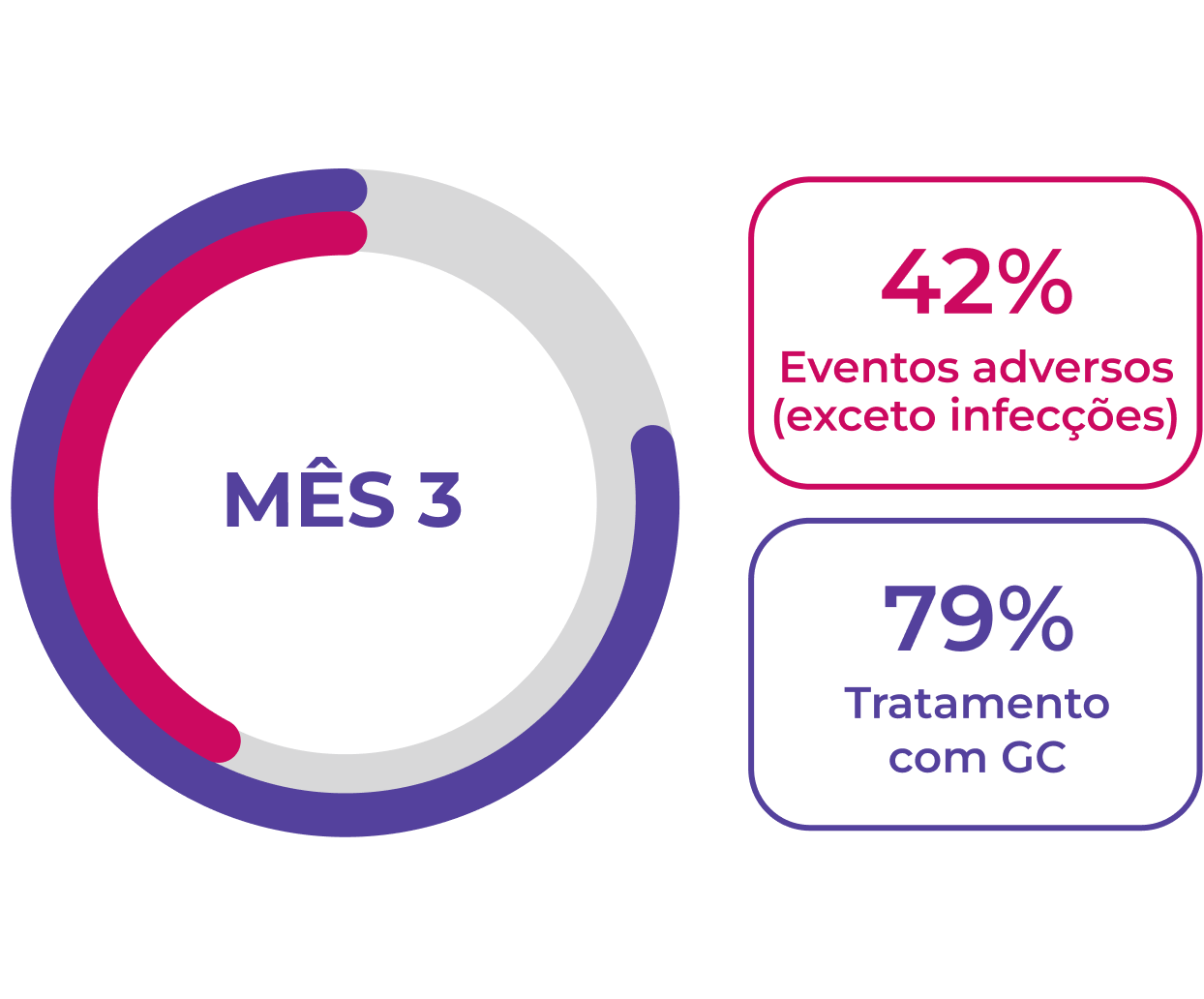

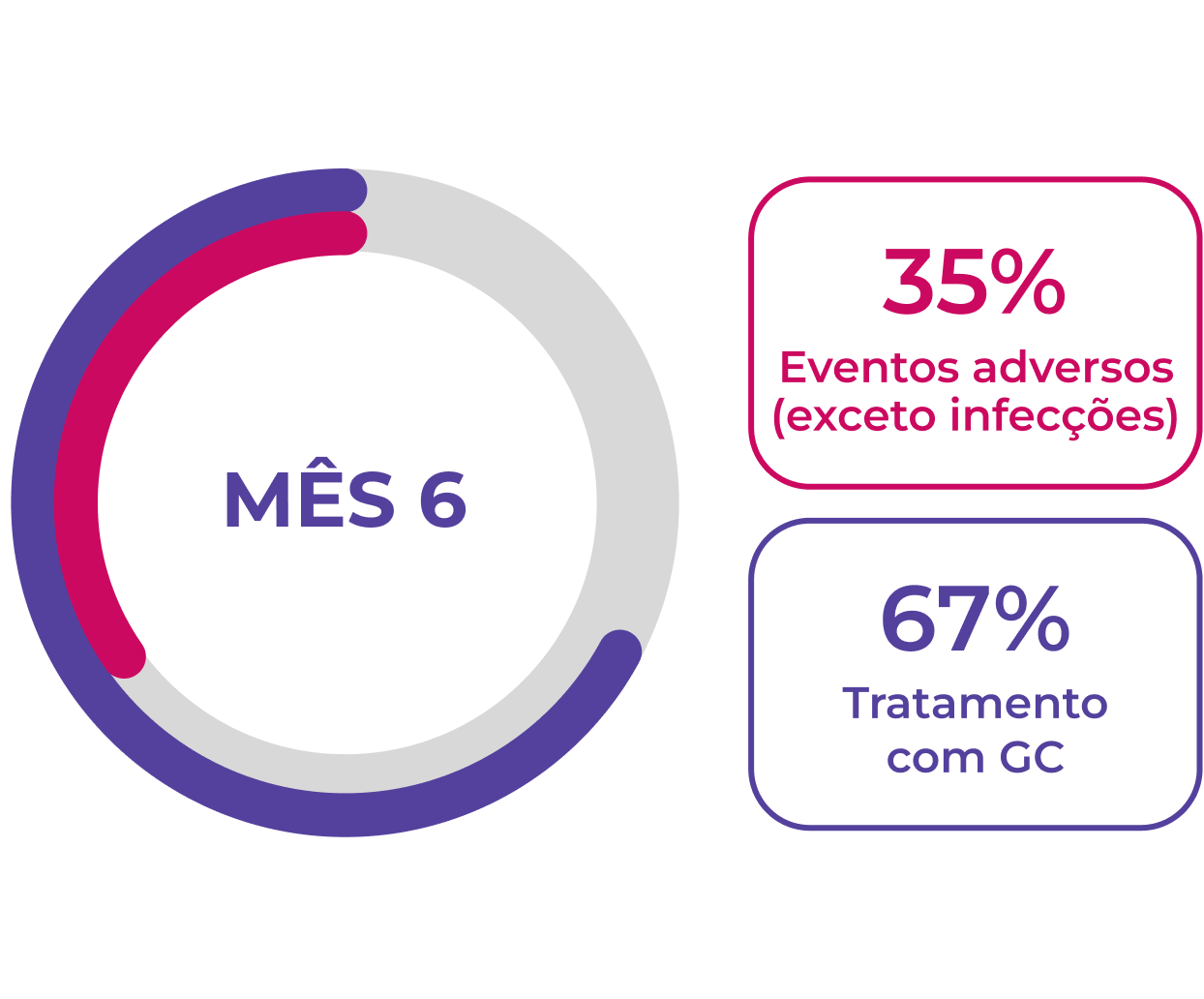
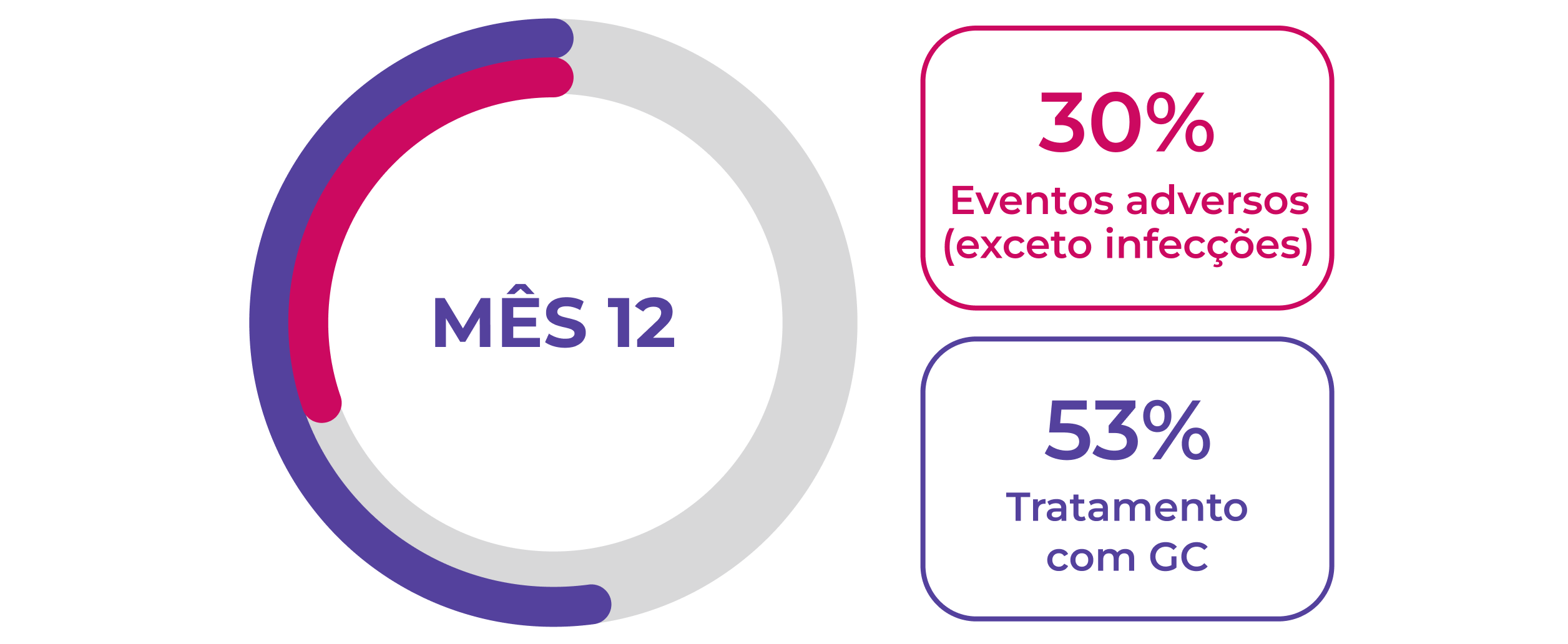


Pacientes recidivantes (n=268)2†
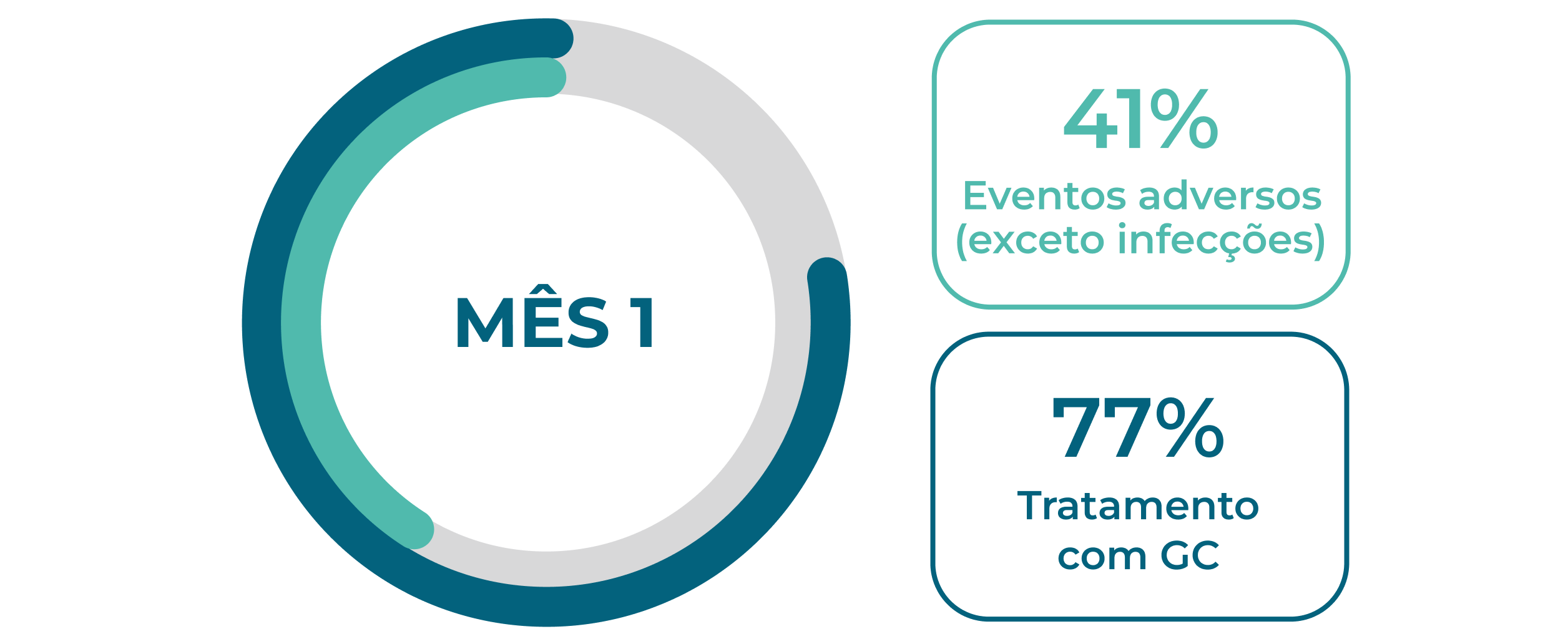
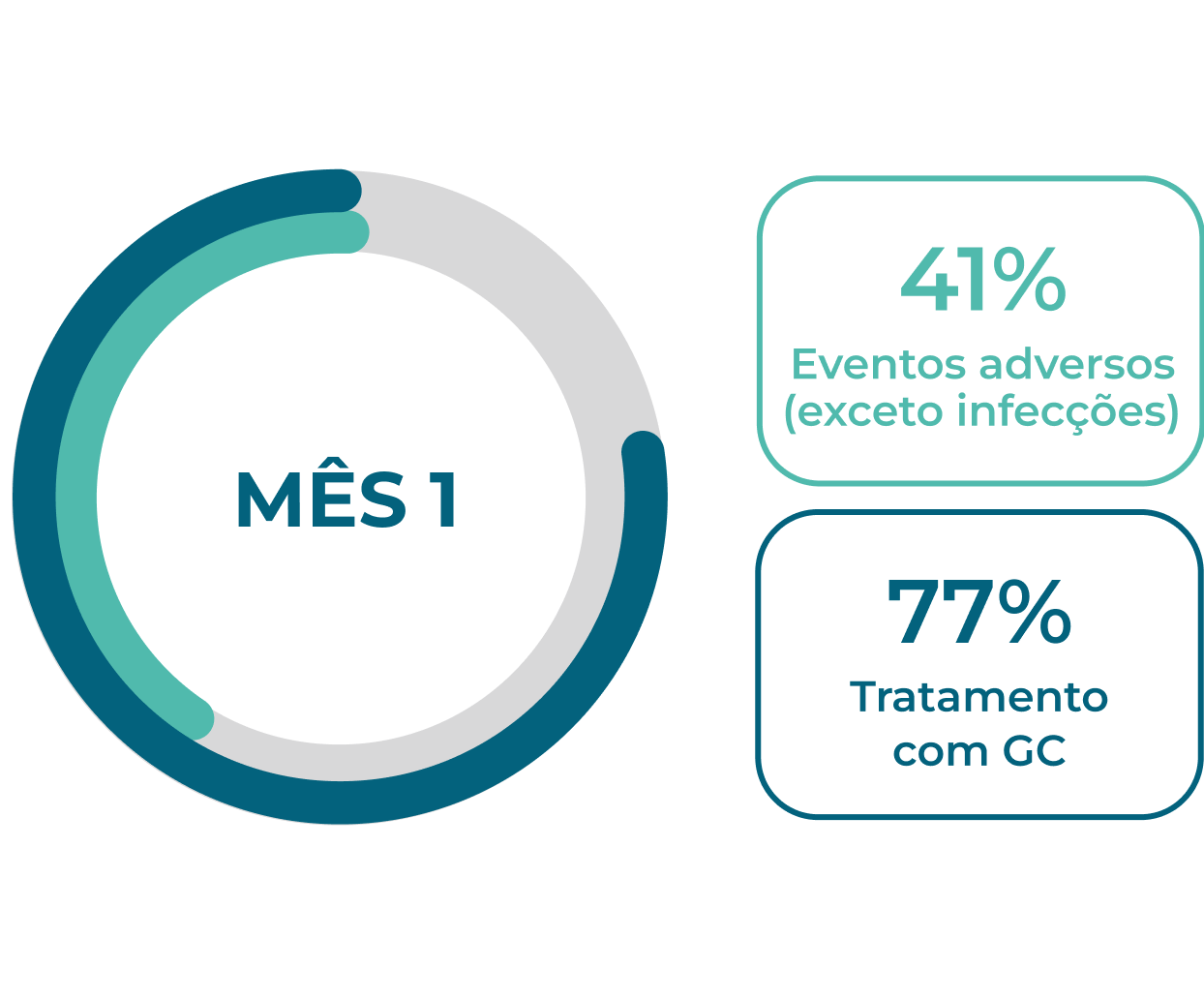

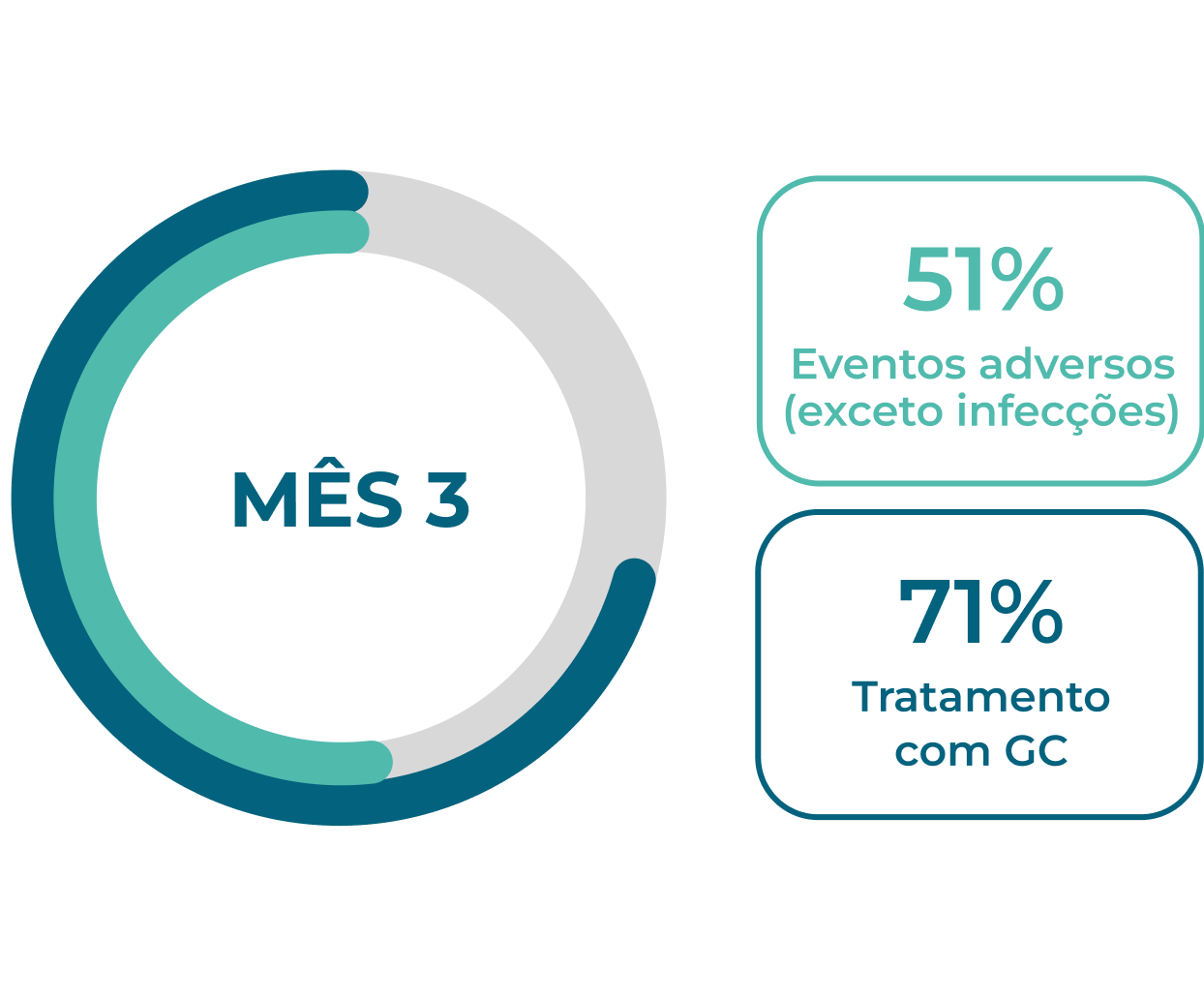

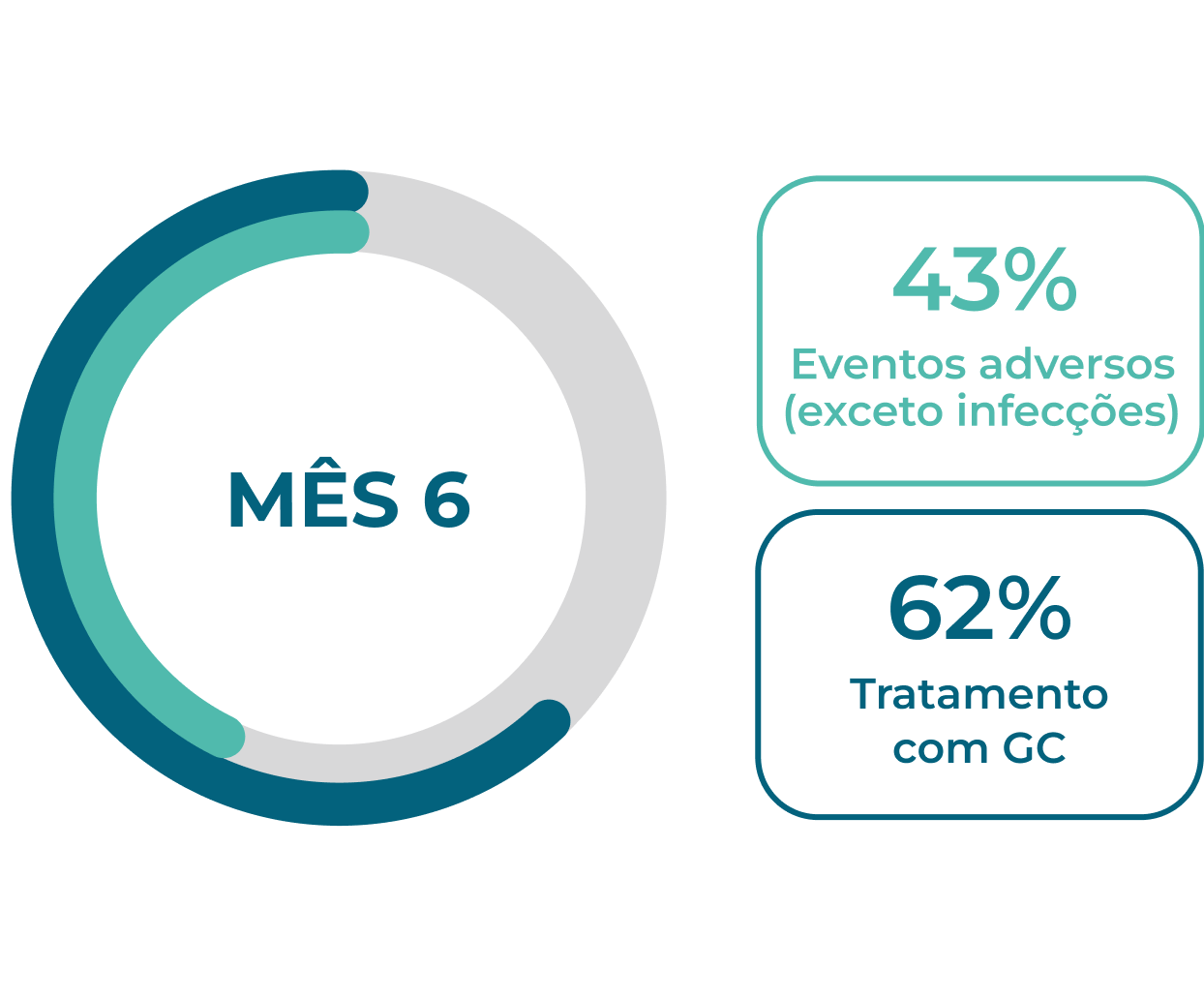


Referências e notas de rodapé
Notas de rodapé
**Auditoria clínica retrospectiva de prontuários médicos de 929 pacientes com VAA incidente (GPA: 54%; PAM: 46%; idade média: 57 anos; sexo masculino: 54%) na França, Alemanha, Itália e Reino Unido (399 médicos) que iniciaram a terapia de indução da remissão entre novembro de 2014 e fevereiro de 2017, com dados coletados na avaliação inicial e após 1, 3, 6 e 12 meses de tratamento.1
†Estudo retrospectivo analisando 929 pacientes com VAA incidente (GPA: 54%; PAM: 46%; idade média: 57 anos; homens: 54%) e 268 pacientes com VAA com recidiva (GPA: 54%; PAM: 46%; idade média: 58 anos; homens: 60%) da França, Alemanha, Itália e Reino Unido (399 médicos) que iniciaram terapia de indução de remissão entre novembro de 2014 e fevereiro de 2017 com dados coletados na avaliação inicial e após 1, 3, 6 e 12 meses de tratamento.1,2
Abreviações
VAA, vasculite associada ao ANCA; EA, evento adverso; ANCA, anticorpo anticitoplasma de neutrófilos; CYC, ciclofosfamida; GC, glicocorticoide; GPA, granulomatose com poliangeíte; PAM, poliangeíte microscópica; RTX, rituximabe
Referências
- Rutherford P, et al. Arthritis Rheumatol 2018;70(Suppl 10):Abstract 2724.
- Rutherford PA, et al. J Am Soc Nephrol 2018;29:839(Abstract SA-PO402).
- Yates M, et al. Ann Rheum Dis 2016;75(9):1583–94.
BR-AVA-2500003 | Data de preparação: julho de 2025
Recursos adicionais
BR-AVA-2500003 | Data de preparação: julho de 2025

Mantenha-se informado
Cadastre-se para receber as informações da CSL Vifor, incluindo conteúdos promocionais.
Inscreva-se na newsletter